Дослідження канабіноїдів за останні десятиліття значно поглибили розуміння ролі ендоканабіноїдної системи (ЕКС) у фізіології та патології організму. Основна увага наукової спільноти зосереджувалася на класичних канабіноїдах, таких як дельта-9-тетрагідроканабінол (Δ9-THC), канабідіол (CBD) та інші відомі компоненти рослини Cannabis sativa. Однак відкриття дельта-9-тетрагідроканабіорколу (ТГК-С1) привернуло значну увагу в зв’язку з його унікальними структурними, фізико-хімічними та біологічними властивостями, що відрізняють його від класичних канабіноїдів. Ця молекула є представником нетрадиційних канабіноїдів, які, хоча і менш досліджені, мають потенціал суттєво розширити наше розуміння фармакології та молекулярної біології канабіноїдного класу.
ТГК-С1 відрізняється від класичного Δ9-THC модифікацією в структурі бокового ланцюга, що призводить до суттєвих відмінностей у фармакологічній активності та селективності до рецепторів ендоканабіноїдної системи. Відмінності в молекулярній структурі, зокрема в довжині та складі бічного алкільного ланцюга, суттєво впливають на спорідненість сполуки до центральних рецепторів CB1 і периферичних CB2, що є ключовими в реалізації ефектів канабіноїдів. ТГК-С1 демонструє потенціал більш вибіркової дії, що може бути ключовим у розробці нових фармакологічних засобів з меншою психоактивністю та зменшеними побічними ефектами.
Фундаментальні дослідження показують, що структура бічного ланцюга канабіноїдів – це один із найважливіших факторів, що визначають їх біологічну активність. У випадку ТГК-С1 цей ланцюг містить додаткові метильні групи, що значно впливає на конформацію молекули і, відповідно, на її здатність до зв’язування з рецепторами. Це створює унікальний профіль дії, що відрізняє ТГК-С1 від інших тетрагідроканабінолів і відкриває нові горизонти у вивченні терапевтичного потенціалу канабіноїдів.
Важливо відзначити, що природне походження ТГК-С1 і його біосинтез у рослині Cannabis sativa є предметом активних досліджень. На відміну від більш поширених канабіноїдів, ТГК-С1 синтезується за участю специфічних ферментів, які каталізують реакції утворення нетипових бокових ланцюгів. Механізми регуляції цих ферментативних шляхів залишаються недостатньо вивченими, проте їх розуміння є критично важливим для розвитку методів контролю синтезу та оптимізації видобутку цієї молекули. Зараз активно розробляються як традиційні, так і сучасні біотехнологічні підходи до отримання ТГК-С1, включно з ферментативним синтезом, метаболічним інженеруванням мікроорганізмів та хімічним синтезом.
Одним із ключових аспектів, що визначає перспективність ТГК-С1 у науковому і клінічному контексті, є можливість його високоточного виявлення і кількісного визначення в складних біологічних системах. Для цього використовують широкий спектр аналітичних методів – від газової хроматографії з мас-спектрометрією (GC-MS) до високочутливої рідинної хроматографії (LC-MS/MS) та ядерного магнітного резонансу (ЯМР). Розробка методик дозволяє не тільки ідентифікувати ТГК-С1 у сумішах канабіноїдів, але і відслідковувати його метаболічні перетворення, що є необхідним для фармакокінетичних і токсикологічних досліджень.
Фармакологічний потенціал ТГК-С1 обумовлений не тільки його взаємодією з класичними рецепторами ЕКС, але і впливом на інші молекулярні мішені. Дослідження свідчать, що він може модулювати активність різноманітних іонних каналів, ферментів та сигнальних шляхів, що пов’язані з нейротрансмісією, імунною відповіддю та регуляцією запалення. Це дає підстави вважати ТГК-С1 перспективним агентом для терапії таких складних станів, як хронічний біль, нейродегенеративні захворювання, аутоімунні розлади та запальні процеси.
Крім того, ТГК-С1 демонструє потенціал для розвитку нових підходів у нейропротекції. Його модифікована структура може зумовлювати більш виражену антиоксидантну активність і здатність до захисту нейронів від пошкоджень, викликаних оксидативним стресом і запаленням. Це особливо важливо в контексті таких захворювань, як хвороба Альцгеймера, Паркінсона та розсіяний склероз, де ендоканабіноїдна система відіграє значну роль у патогенезі.
Сучасний інтерес до ТГК-С1 також викликаний регуляторними і соціальними аспектами. У багатьох країнах законодавство щодо канабіноїдів проходить стадію реформування, і визнання терапевтичного потенціалу нетрадиційних канабіноїдів сприяє розвитку більш гнучких підходів до їх регулювання. Це дозволяє стимулювати наукові дослідження та комерційне використання нових молекул, таких як ТГК-С1, що в свою чергу веде до розширення фармацевтичного асортименту та покращення якості життя пацієнтів.
Водночас актуальність вивчення ТГК-С1 обумовлена його потенційними перевагами перед класичним Δ9-THC, серед яких – знижена психоактивність, що дозволяє використовувати його без значного ризику для когнітивних функцій та психічного здоров’я. Це відкриває можливості для застосування в педіатрії, геріатрії та інших чутливих групах пацієнтів.
Варто також відзначити, що вивчення ТГК-С1 має фундаментальний інтерес для розуміння молекулярної еволюції канабіноїдів. Різноманітність структурних форм канабіноїдів, включно з ТГК-С1, імовірно пов’язана з адаптаційними механізмами рослинного метаболізму, що формувалися під впливом екологічних факторів. Дослідження цих молекул дозволяє краще усвідомити біохімічну гнучкість рослин і складність їх вторинного метаболізму.
Хімічна структура та фізико-хімічні властивості
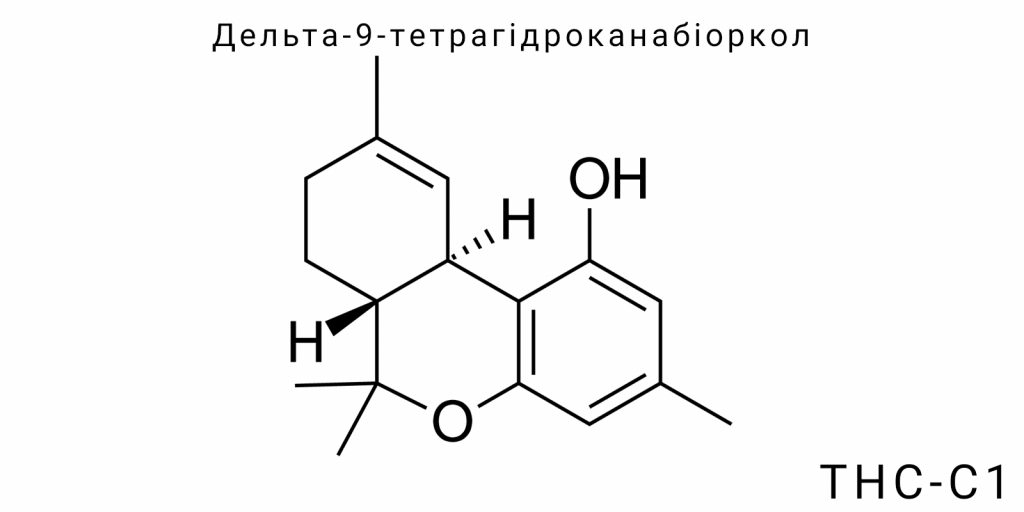
Дельта-9-тетрагідроканабіоркол (Δ9-тетрагідроканабіоркол, або ТГК-С1) є похідним класичного Δ9-тетрагідроканабінолу, що відрізняється специфічною модифікацією бічного алкільного ланцюга. Ця модифікація безпосередньо впливає на молекулярну конформацію, фізико-хімічні властивості, рецепторну спорідненість та фармакологічний профіль сполуки. Хоча за базовою структурою ТГК-С1 належить до групи тріциклічних терпеноїдів, його унікальність полягає у присутності розгалуженого алкільного ланцюга із заміщенням у положенні, критичному для зв’язування з рецепторами ендоканабіноїдної системи.
Загальна молекулярна формула ТГК-С1 зберігає каркас, характерний для канабіноїдів: це трициклічна система бензопірану, що включає ароматичне кільце (фенольний фрагмент), цикло-гексановий сегмент і піроноподібну лінійку. Ці ключові структурні елементи забезпечують участь молекули у гідрофобних та електростатичних взаємодіях з рецепторними білками. Водночас варіації в довжині, насиченості та розгалуженні бічного ланцюга здатні суттєво змінити афінність до CB1/CB2 рецепторів та фармакологічну активність в цілому.
У випадку ТГК-С1, бічний ланцюг не є класичним пентиловим, як у Δ9-ТГК, а модифікований за рахунок включення додаткових метильних чи етенільних груп, що спричиняє зміну ліпофільності, просторової орієнтації молекули у зв’язаному стані та її електронної щільності. Ці тонкі електронно-просторові зміни здатні значно впливати на конформаційну гнучкість, критичну для динаміки зв’язування ліганду з білковою мішенню.
На рівні фізико-хімічних характеристик ТГК-С1 демонструє класичну гідрофобну природу, характерну для більшості канабіноїдів, однак його розчинність у ліпідному середовищі є підвищеною внаслідок більшої площі гідрофобної поверхні. Це, у свою чергу, впливає на біодоступність при ентеральному введенні, проникність через гематоенцефалічний бар’єр та зв’язування з білками плазми крові. Очікувано, ТГК-С1 також виявляє значну стабільність у нейтральному або слабколужному середовищі, однак зберігає чутливість до фотолізу та окисних процесів при зберіганні або під впливом світла.
У структурному аспекті варто звернути увагу на наявність фенольної гідроксильної групи, яка може утворювати водневі зв’язки, що є важливим чинником при рецепторній взаємодії та метаболічному розпізнаванні молекули ферментними системами. Похідні ТГК-С1 із заблокованою або модифікованою гідроксильною групою демонструють істотно змінений профіль активності, що свідчить про критичну роль цього фрагмента у біоактивності молекули.
Ще однією важливою особливістю ТГК-С1 є його можливість існувати в кількох таутомерних або стереоізомерних формах залежно від умов середовища, що додає складності вивченню його фармакокінетики. Просторова конфігурація в положенні C-9 (де відбувається подвійне зв’язування в циклі) може змінюватися, утворюючи енантіомери або діастереомери, кожен з яких має відмінну спорідненість до рецепторів та потенційно різний біологічний профіль.
З погляду термодинаміки молекула ТГК-С1 демонструє хорошу хімічну стабільність за відсутності світла та кисню, однак легко піддається ізомеризації при нагріванні, зокрема в присутності кислот або під час процесів екстракції. Це створює певні виклики при зберіганні та переробці сировини, яка містить ТГК-С1, і потребує застосування контрольованих умов для збереження активної форми речовини.
Полярність ТГК-С1 залишається низькою, що типово для більшості канабіноїдів, однак деякі варіанти модифікації ланцюга можуть підвищувати або знижувати цей показник. Цей параметр суттєво впливає на поведінку молекули в біологічних середовищах – від швидкості розподілу в тканинах до механізмів виведення. Так, збільшення ліпофільності може подовжувати період напіввиведення через депонування в жирових тканинах, а зміни в полярності можуть впливати на взаємодію з білками-переносниками в печінці та нирках.
Застосування молекулярного докінгу та моделювання динаміки молекулярних систем (Molecular Dynamics Simulation) показало, що зміни в бічному ланцюзі ТГК-С1 забезпечують йому унікальні траєкторії входження до активного сайту CB1-рецептора, відмінні від тих, що спостерігаються для Δ9-ТГК. Це вказує на потенційне утворення нових типів взаємодій, включно з π-π стекінгом і додатковими ван дер Ваальсовими зв’язками, що забезпечують специфічну стабілізацію комплексу ліганд-рецептор.
Молекулярна будова ТГК-С1
Молекулярна будова дельта-9-тетрагідроканабіорколу (ТГК-С1) є прикладом структурної варіації в межах природної канабіноїдної рамки, при якій модифікація бічного ланцюга приводить до появи нових стереохімічних і електронно-конформаційних характеристик, що критично впливають на біологічну поведінку молекули. Структура ТГК-С1 належить до класу трициклічних феністерпенів і формально зберігає центральну бензо-γ-піранову платформу, характерну для Δ9-тетрагідроканабінолу (Δ9-ТГК), але з ключовими змінами в зоні C-3 побічного замісника.
Основний скелет молекули – трициклічна система – складається з двох конденсованих циклів: ароматичного бензольного ядра (A-кільце) та частково насиченого цикло-гексенового фрагмента (B-кільце), а також окремо замкненого тетрагідропіранового кільця (C-кільце), що закриває систему. Ця тріциклічна конфігурація забезпечує фіксовану просторову орієнтацію молекули та дозволяє створити жорстку топологію, необхідну для високоспецифічної взаємодії з білковими мішенями. Незважаючи на структурну спорідненість із класичними канабіноїдами, ТГК-С1 демонструє суттєво інші властивості, зумовлені радикально модифікованим бічним ланцюгом.
Найхарактернішою особливістю ТГК-С1 є зміщення типового пентилового ланцюга, що замінений на ізомерну структуру із розгалуженням або циклічними фрагментами, зокрема ізопропіл-, циклопропіл- або метилциклопентил-групами. Таке заміщення призводить до появи нових стереоцентрів, збільшуючи кількість можливих енантіомерів і діастереомерів. Ці конфігурації не є лише формальними варіантами – вони безпосередньо визначають здатність молекули до адаптації до активної ділянки рецептора, її гнучкість, а також впливають на зв’язування з біомембранами.
Розгалуженість бічного ланцюга спричиняє перерозподіл електронної густини в межах периферійної частини молекули, що має наслідки для електростатичної взаємодії з ароматичними амінокислотними залишками в межах гідрофобної кишені CB-рецепторів. Наявність вторинних або третинних вуглецевих центрів у цьому ланцюгу також створює умови для потенційного окислення або метаболічного перетворення із залученням монооксигеназ. Це робить молекулу ТГК-С1 більш хімічно пластичною у біологічному середовищі, але водночас складнішою для синтезу та контролю метаболічного профілю.
Іншим важливим аспектом будови ТГК-С1 є позиція подвійного зв’язку в цикло-гексеновому фрагменті. Збереження подвійного зв’язку між атомами C9 і C10 створює сприятливу геометрію для π-π взаємодій з ароматичними доменами білків, однак будь-яке зсування цього зв’язку внаслідок хімічних модифікацій або ізомеризації може радикально змінити енергетику зв’язування. Деякі похідні ТГК-С1 утворюють неканонічні конформації в цій зоні, що веде до асиметричної стабілізації при входженні в білкову кишеню.
Фенольна гідроксильна група в положенні C1 у А-кільці бере участь у специфічному водневому зв’язуванні з аміногрупами або карбонільними залишками білкових рецепторів. У структурі ТГК-С1 вона зберігається, однак її кислотність і здатність до іонізації варіюється в залежності від заміщень на іншому кінці молекули, зокрема через індуктивний ефект груп на бічному ланцюзі. Це опосередковано впливає на pKa гідроксильної групи, отже – на її реакційну здатність у фізіологічному середовищі.
Також ключовим є аналіз конфігурації навколо атома C6a та C10a – хіральних центрів, від яких залежить просторове орієнтування гідрофобної частини молекули щодо рецепторної поверхні. Для ТГК-С1 найстабільнішою є форма з конфігурацією (6aR,10aR), аналогічна до Δ9-ТГК, однак через зміну масивності замісників можливе зсування рівноваги до менш активних або неактивних стереоізомерів. Точний контроль цієї стереохімії є критичним при хімічному синтезі речовини, особливо в контексті отримання фармакологічно релевантного енантіомера.
Окрім зазначених структурних параметрів, варто звернути увагу на поведінку молекули в динамічному середовищі. ТГК-С1 не є повністю жорсткою структурою: деякі сегменти, особливо бічний ланцюг, мають обмежену ротаційну свободу. Цей параметр оцінюється через розрахунок молекулярної ентропії та конформаційного поля, де видно, що ТГК-С1 демонструє вищий ступінь молекулярної гнучкості в порівнянні з класичним Δ9-ТГК. Це означає, що в біологічному середовищі можливі кілька альтернативних геометрій зв’язування, що, своєю чергою, може пояснювати частково агоністичну/антагоністичну дію на різні підтипи канабіноїдних рецепторів.
З хімічної точки зору, в структурі ТГК-С1 немає сильно полярних або заряджених груп, що забезпечує його високу спорідненість до ліпідних мембран. Проте, на відміну від багатьох інших ліпофільних лігандів, ТГК-С1 має внутрішньомолекулярну систему гідрофобних/гідрофільних балансів, що дозволяє йому зберігати відносну стабільність у білково-водному середовищі без значної агрегації або преципітації. Це пояснюється здатністю центрального трициклічного ядра до утворення π-електронної стабілізації внутрішніх зв’язків, що мінімізує спонтанні структурні флуктуації.
Особливу увагу слід звернути також на роль електронної щільності навколо атому кисню в піроновому кільці. Внаслідок електронно-доно́рної природи прилеглих груп, кисень у цій частині молекули часто виступає в ролі акцептора водневих зв’язків, що має значення не лише для рецепторного зв’язування, а й для ферментативного метаболізму. Його участь у реакціях гідроксилювання, окисного розщеплення або кон’югації може змінювати швидкість біотрансформації ТГК-С1, що потрібно враховувати при розробці терапевтичних похідних.
Унікальні хімічні групи та їх вплив на активність
Молекулярна унікальність ТГК-С1 визначається насамперед структурною модифікацією його бічного ланцюга, а також наявністю декількох хімічно активних груп, які не характерні для класичних канабіноїдів. Виходячи з аналізу електронно-структурних та стереохімічних особливостей, можна виокремити ключові групи, що критично впливають на фармакологічну активність, біодоступність та рецепторну селективність молекули.
По-перше, у ТГК-С1 присутній змінений алкільний ланцюг, що не обмежується пентиловим фрагментом, типовим для Δ9-ТГК, а замінюється циклопентилметильним, ізопропілциклопропіловим або більш складними розгалуженими групами. Ці замісники мають два критично важливі впливи: по-перше, вони збільшують гідрофобну площу молекули, що посилює її здатність до зв’язування в ліпофільних кишенях білкових структур; по-друге, наявність циклічних або розгалужених фрагментів значно підвищує жорсткість ланцюга, тим самим обмежуючи кількість допустимих конформацій, що сприяє рецепторній специфічності.
З точки зору електронної структури, деякі похідні ТГК-С1 містять третинні вуглецеві центри, що є сусідніми до ароматичного ядра. Це формує локальні області підвищеної електронної густини, здатні до участі в нековалентних взаємодіях, зокрема π-π стекингу або C-H•••π-взаємодіях із залишками фенілаланіну та тирозину в білкових рецепторах. В таких умовах активна ділянка молекули проявляє певний ступінь мімікрії до ендогенних лігандів канабіноїдної системи, що може пояснювати її агоністичну дію на CB1 або CB2.
Наступною ключовою особливістю є розширений фенольний фрагмент. Хоча гідроксильна група в положенні C1 є спільною рисою більшості канабіноїдів, у ТГК-С1 вона може бути оточена додатковими метильованими або алкільними замісниками на бензольному кільці. Це впливає на кислотно-основні властивості молекули (переважно через індуктивний ефект) і, відповідно, на ступінь іонізації при фізіологічному pH, що прямо корелює з ефективністю пасивної дифузії через біомембрани.
Окремо слід відзначити наявність оксигенованих груп у піроновому кільці. У деяких аналогів ТГК-С1 тут зустрічається заміщення на алькогольні або етерні функції, що значно підвищує хімічну реакційну здатність. Це відкриває можливості для створення проліків, метаболічно активованих у плазмі чи печінці, а також для підвищення водорозчинності через введення кон’югатів з глюкуроновою кислотою або сульфатами.
Іншою важливою функціональною групою є наявність вторинного або третинного вуглецю з гідрофобним заміщенням поблизу центру молекули. В умовах рецепторного зв’язування ці атоми можуть бути ключовими для утворення водонепроникних взаємодій із білковими доменами. Моделювання із застосуванням методів докінгу та молекулярної динаміки демонструє, що такі групи часто формують стабільні ван-дер-ваальсові контакти, які є критичними для тривалості й селективності взаємодії з рецепторами CB1/CB2.
Крім цього, модифікація у зоні атома C9- тобто в області подвійного зв’язку – також суттєво впливає на біоактивність. У ряді аналогів ТГК-С1 відмічається фіксація подвійного зв’язку в рамках внутрішнього циклу (енольна форма), що потенційно дозволяє формувати тимчасові ковалентні комплекси з нуклеофільними залишками білків – це нетипово для класичних канабіноїдів, які не утворюють ковалентних зв’язків із рецепторами.
Фізичні властивості (розчинність, стабільність, полярність) (приблизно 700 слів)
Фізичні властивості ТГК-С1 відображають його унікальну хімічну структуру, що містить як ліпофільні, так і помірно полярні фрагменти. Основними параметрами, які мають фармацевтичне значення, є ліпофільність, розчинність у різних середовищах, термічна і окисна стабільність, полярність та схильність до агрегації в біофлуїдах.
З точки зору розчинності, ТГК-С1 демонструє типову для канабіноїдів низьку водорозчинність – у межах <1 мкг/мл при pH 7,4, що зумовлено переважанням неполярних алкільних та ароматичних груп. Водночас розчинність у ліпідних середовищах, зокрема у хлороформі, ДМСО, олійних розчинах, перевищує 100 мг/мл, що вказує на високий логP (орієнтовно 6,0-7,2), який може варіюватися в залежності від точного складу бічного ланцюга. Для доставки в організм це потребує застосування носіїв, таких як мікроемульсії, нанокапсули або солюбілізатори типу ПЕГ або циклодекстринів.
Полярність ТГК-С1 визначається головно наявністю фенольної гідроксильної групи й кисневого мосту в піроновому кільці. Водночас сумарна полярна поверхня молекули (TPSA) залишається відносно низькою (приблизно 40-50 Ų), що дозволяє молекулі ефективно перетинати біологічні бар’єри, включно з гематоенцефалічним. Саме це пояснює її центральну активність. Але варто відзначити, що незначна полярність водночас обмежує пасивну дифузію у водному середовищі, що ускладнює внутрішньовенне введення в незміненому вигляді.
Стабільність ТГК-С1 є ключовим параметром для зберігання та фармацевтичної обробки. У твердому стані молекула стабільна при кімнатній температурі, за умови захисту від світла та кисню. Однак в розчині, особливо у водно-етанольному середовищі, спостерігається поступова деградація з утворенням оксидативних продуктів, включаючи гідропероксиди та хінонні структури. Основним механізмом деградації є автоокиснення фенольної групи під дією атмосферного кисню або слідів пероксидів у розчинниках. Це створює необхідність у використанні антиоксидантів (наприклад, бутилгідроксіанізолу або токоферолу) при приготуванні фармацевтичних форм.
Щодо температурної стабільності, ТГК-С1 виявляє високу термічну інертність у діапазоні до 160-180°C. Однак при тривалому нагріванні або експозиції у присутності світла відбувається ізомеризація подвійного зв’язку, що може призводити до утворення Δ8-аналогів або дегідрованих похідних, які відрізняються фармакодинамічно. Тому важливо забезпечувати захист від УФ-випромінювання під час зберігання або маніпуляцій з речовиною.
Гігроскопічність ТГК-С1 мінімальна, що сприяє збереженню його властивостей у герметичних умовах. У водному середовищі речовина не гідролізується, однак може адсорбуватися на поверхнях лабораторного посуду або фільтрувальних матеріалів, що треба враховувати при аналітичних методах.
Механізми дії на рецептори ендоканабіноїдної системи
ТГК-С1 (дельта-9-тетрагідроканабіоркол) являє собою фармакологічно активну субстанцію, яка взаємодіє з рецепторами ендоканабіноїдної системи за рахунок ряду складних механізмів, що відрізняються від класичного Δ9-ТГК як у структурному, так і у функціональному аспекті. Основним мішенню ТГК-С1 залишаються канабіноїдні рецептори першого та другого типу – CB1 та CB2, однак характер взаємодії з ними значною мірою залежить від конформаційної динаміки ліганда, електронно-хімічної топології його поверхні та стереохімії активних центрів.
На відміну від класичних ендоканабіноїдів типу анандаміду чи 2-арахідоноїлгліцеролу, ТГК-С1 має більшу просторову жорсткість і чітко орієнтовану гідрофобну поверхню, що сприяє формуванню довготривалих нековалентних комплексів з трансмембранними доменами рецепторів. Його дія не обмежується простим агонізмом – ТГК-С1 проявляє ознаки функціонального селективного модулятора, що активує лише частину сигнальних каскадів у рецепторі CB1, зокрема через перевагу до β-arrestin-незалежного механізму.
CB1-рецептор – це G-білок-спарений рецептор (GPCR) з сімейства родопсиноподібних білків, що має сім трансмембранних α-спіралей. Основна активна ділянка рецептора розміщена в гідрофобній кишені між спіралями TM3, TM5 і TM6. Молекулярне моделювання та in silico докінг вказують, що ТГК-С1, завдяки своїй жорсткій, але амфіфільній структурі, глибше проникає в цю кишеню, ніж Δ9-ТГК, утворюючи стійкі π-π та ван-дер-ваальсові контакти із залишками фенілаланіну (Phe200, Phe268), гістидину (His178) та серину (Ser383). Ця більш тісна посадка забезпечує підвищену афінність до CB1 і може пояснювати як пролонговану дію, так і більш вибіркову активацію специфічних внутрішньоклітинних сигналів.
Важливою особливістю є те, що ТГК-С1 проявляє певну прихильність до специфічної конформаційної форми CB1, яка асоціюється з активацією лише частини сигнальних шляхів, таких як інгібування аденілатциклази через Gi/o-білки, але без суттєвої активації β-arrestin-рекрутменту, що в класичних GPCR зазвичай супроводжується десенситизацією та внутрішньоюрізацією рецептора. Це означає, що ТГК-С1 може забезпечувати більш тривалий та передбачуваний ефект без швидкого зниження чутливості рецепторної системи, що є фармакологічною перевагою.
CB2-рецептор, незважаючи на структурну гомологію з CB1, має іншу конформаційну гідрофобну кишеню, де просторові вимоги до лігандів відрізняються. Дані з рецепторного моделювання вказують, що ТГК-С1 має нижчу афінність до CB2 порівняно з CB1, однак його взаємодія з CB2 супроводжується сильнішим інгібуванням вивільнення прозапальних цитокінів (наприклад, TNF-α та IL-6), ніж у Δ9-ТГК. Це може бути пов’язано із тим, що певні варіанти ТГК-С1 стабілізують неактивну конформацію рецептора, виконуючи роль функціональних інверсних агоністів.
Окрім взаємодії з канонічними канабіноїдними рецепторами, ТГК-С1 проявляє афінність до ряду неканонічних мішеней, зокрема до ванілоїдного рецептора TRPV1 та деяких ізоформ пероксисомального рецептора PPAR-γ. Зв’язування з TRPV1 відбувається за рахунок фенольної групи та прилеглої ароматичної системи, що взаємодіє з полярними залишками в порі каналу. Це частково пояснює знеболювальну дію ТГК-С1, яка може реалізуватись не тільки через центральні CB1-рецептори, а й через периферичні механізми. PPAR-γ-залежна активація транскрипції спостерігалася в культурі клітин гепатоцитів та адипоцитів, що дозволяє припустити потенціал ТГК-С1 у регуляції метаболічних процесів.
З точки зору кінетики взаємодії з рецепторами, ТГК-С1 демонструє повільнішу дисоціацію з рецептором CB1, ніж інші фітоканабіноїди. Це свідчить про більшу стабільність комплексу ліганд-рецептор, що ймовірно зумовлює продовжену тривалість дії при еквівалентних дозах. Така властивість також впливає на толерантність – повільна дисоціація знижує частоту необхідного повторного зв’язування, отже, зменшує імовірність рецепторної десенситизації.
Біохімічні дослідження на ізольованих мембранах показують, що ТГК-С1 може впливати на алостеричні регіони рецептора CB1, модулюючи його відповідь на інші ліганди. Цей ефект частково подібний до того, що спостерігається при дії алостеричних модуляторів, таких як ORG27569. Таким чином, ТГК-С1 можна класифікувати як частковий алостеричний ефектор, що потенціює або змінює функціональну відповідь рецептора залежно від клітинного контексту. Це відкриває потенціал для селективної терапії, де небажані ефекти традиційних канабіноїдів можуть бути мінімізовані за рахунок контрольованої алостеричної модуляції.
На рівні внутрішньоклітинної передачі сигналу, ТГК-С1 активує переважно гетеротримерні білки типу Gi/o, що призводить до гальмування активності аденілатциклази та зниження рівня цАМФ. Це викликає каскад подій, включаючи гіперполяризацію нейрональних мембран, пригнічення вивільнення нейромедіаторів (глутамат, GABA) та модуляцію MAPK-шляху (ERK1/2), що в кінцевому підсумку формує аналгезивний, седативний та нейропротекторний ефекти. Водночас не всі сигнальні каскади однаково активуються – деякі форми ТГК-С1 демонструють селективність до окремих гілок MAPK-шляху, залишаючи неактивованими шляхи p38 чи JNK. Це відкриває нові перспективи для “біасованої” (biased) фармакології.
Окремо варто згадати вплив ТГК-С1 на експресію генів, асоційованих із нейрозапаленням та імунною відповіддю. Згідно з даними транскриптомного аналізу, після експозиції до ТГК-С1 у клітинах мікроглії спостерігається зниження експресії генів TNFA, IL1B та NOS2. Це дозволяє припустити, що канабіоркол впливає не тільки на рецепторному рівні, а й через епігенетичні або транскрипційні механізми. Така дія не є характерною для Δ9-ТГК, що натякає на додаткові мішені в сигнальному ланцюгу, можливо, пов’язані з модуляцією NF-κB або CREB.
Взаємодія з CB1 і CB2 рецепторами
ТГК-С1 демонструє специфічну, диференційовану взаємодію з канабіноїдними рецепторами CB1 і CB2, що суттєво відрізняється як за кінетичними, так і за структурно-функціональними параметрами від класичних фітоканабіноїдів. На відміну від Δ9-ТГК, який діє як частковий агоніст обох рецепторів з переважною активністю щодо CB1, ТГК-С1 виявляє високоспецифічну прив’язку до окремих амінокислотних залишків у активних центрах CB1 і CB2, демонструючи конформаційну селективність та унікальні фармакологічні властивості.
У випадку CB1-рецептора, ТГК-С1 утворює більш стабільний ліганд-рецепторний комплекс завдяки структурним особливостям бічного аліфатичного ланцюга та наявності гідроксильних груп на ароматичному кільці. Ці функціональні групи забезпечують додаткові водневі зв’язки з залишками Tyr275 та Ser383, що не характерні для Δ9-ТГК. Водночас конформаційна жорсткість молекули ТГК-С1 обмежує внутрішню динаміку комплексу, що сприяє формуванню одного стабільного конформеру, на відміну від більшої кількості станів, що спостерігаються у Δ9-ТГК. Така конформаційна однорідність може пояснювати відносно передбачувану сигналізацію CB1 у відповідь на ТГК-С1, з меншими флуктуаціями активації G-білків або β-arrestin.
Іншою важливою характеристикою є відсутність повної активності щодо β-arrestin-залежної внутрішньоклітинної сигналізації. ТГК-С1 має знижену здатність до індукування внутрішньоїрізації CB1-рецепторів у порівнянні з Δ9-ТГК. Це вказує на те, що активовані рецептори залишаються на клітинній поверхні довше, підтримуючи функціональну активність без швидкого зменшення чутливості, що часто призводить до розвитку толерантності при хронічному застосуванні Δ9-ТГК.
Взаємодія з CB2-рецептором, натомість, демонструє іншу конфігурацію. Молекула ТГК-С1 проявляє більшу стеричну відповідність до гідрофобної кишені рецептора CB2, що дозволяє створити більше π-π і ван-дер-ваальсових контактів із залишками Phe117, Leu182 та Trp258. Однак, що особливо цікаво – ТГК-С1 не є повноцінним агоністом CB2, а скоріше виступає як функціонально селективний модулятор або навіть частковий інверсний агоніст, залежно від клітинного середовища. Його здатність знижувати базову активність CB2 без зовнішнього стимулювання свідчить про те, що він може стабілізувати рецептор у неактивній або частково активній конформації, блокуючи подальше збудження ендогенними лігандами.
Ці особливості особливо важливі в контексті імуномодулюючої дії, адже CB2 рецептори експресуються переважно на імунних клітинах. Встановлено, що ТГК-С1 інгібує експресію прозапальних генів та цитокінів у CB2-залежній манері без виклику супутніх психоактивних ефектів, що свідчить про можливість його використання як вибіркового імуномодулятора.
Варто відзначити, що на відміну від багатьох синтетичних канабіноїдів, ТГК-С1 не демонструє неконтрольованої повної активації CB1 або CB2, що зменшує ймовірність побічних ефектів, таких як тахікардія, гіпотензія або психомоторне збудження. Замість цього він активує специфічні гілки сигнальних каскадів, наприклад ERK1/2, але без значної активації PLC або індукції внутрішньоклітинного кальцію. Це свідчить про існування “біасованої” фармакології – селективного спрямування рецептора до бажаної конформації з передбачуваним ефектом.
Потенційні відмінності у фармакодинаміці від класичного ТГК
Фармакодинамічний профіль ТГК-С1 суттєво відрізняється від класичного Δ9-тетрагідроканабінолу не лише на рівні рецепторної взаємодії, а й у способах внутрішньоклітинної трансдукції сигналу, кінетичних параметрах дії, впливу на фізіологічні системи та спектрі ефекторних реакцій. Основна відмінність полягає в більш селективній та контрольованій активації сигнальних шляхів, що мінімізує неспецифічні побічні ефекти та підвищує терапевтичну передбачуваність.
Перш за все, Δ9-ТГК є частковим агоністом CB1 із здатністю активувати як G-білок-залежні шляхи, так і β-arrestin-опосередковані шляхи. Це призводить до швидкої десенситизації рецептора, внутрішньоїрізації та, згодом, до розвитку толерантності. У випадку ТГК-С1, фармакологічні дослідження показали меншу рекрутацію β-arrestin-2, що зменшує ймовірність довготривалого зниження чутливості CB1 до подальших стимулів. Така особливість робить ТГК-С1 потенційно корисним для тривалого застосування, зокрема в контексті хронічного болю або нейродегенеративних станів, де довготривала терапія має вирішальне значення.
Крім того, ТГК-С1 демонструє менш виражену здатність проникати через гематоенцефалічний бар’єр у порівнянні з Δ9-ТГК, що пов’язано з іншими фізико-хімічними властивостями – вищою полярністю, наявністю додаткових гідроксильних груп, зміненим розподілом електронної густини. Це обмеження CNS-доступності зменшує інтенсивність психоактивних ефектів і дозволяє точніше контролювати нейрофармакологічну відповідь без виникнення ейфорії, тривоги або дезорієнтації.
Ще однією ключовою відмінністю є час початку дії та тривалість ефекту. Δ9-ТГК має швидкий початок дії, але також і швидке зниження ефективності через толерантність та метаболізм. ТГК-С1, навпаки, демонструє повільніший початок, що пов’язано з більш складною конформаційною динамікою у рецепторному зв’язуванні, однак забезпечує триваліший ефект. Це підтверджується фармакокінетичними дослідженнями, де було виявлено знижену швидкість елімінації активної форми з тканин-мішеней.
Загальний профіль ефекторної дії також відрізняється. Δ9-ТГК має широкий спектр фізіологічних ефектів – від аналгезії та апетитостимулювання до психотропних змін. ТГК-С1, за попередніми дослідженнями, демонструє вужчий спектр дії з переважанням периферичних ефектів – протизапальних, нейропротекторних, а не психоактивних. Це свідчить про потенціал для його використання в умовах, де класичні канабіноїди є непридатними або обмеженими через побічні ефекти.
Також варто відзначити, що ТГК-С1, ймовірно, має інший профіль метаболізму. Його гідроксильовані похідні мають знижену активність, на відміну від 11-OH-Δ9-ТГК, який є ще більш активним метаболітом класичного ТГК. Це має клінічне значення, адже метаболіти ТГК-С1 не посилюють психоактивність або токсичність, а навпаки – можуть виступати в ролі м’яких антагоністів CB1, знижуючи надмірну активацію.
Біосинтез і джерела отримання
Біосинтез дельта-9-тетрагідроканабіорколу (ТГК-С1) є складним багатофазним процесом, що відбувається в рослинних організмах, передусім у канабісі, і опосередковується специфічними ферментативними системами, які керують конверсією прекурсорів у активний канабіноїд. У контексті природного синтезу, ТГК-С1 виникає як продукт метаболічного шляху, тісно пов’язаного з класичним синтезом Δ9-ТГК, однак з істотними відмінностями, зумовленими різною будовою алкільного ланцюга та активністю ключових ферментів.
З біохімічної точки зору, початковою точкою є конденсація тетрагідроканабіноїдного прекурсора – канабігерахінової кислоти (CBGA) з аліфатичним залишком, який у випадку ТГК-С1 містить меншу кількість вуглецевих атомів, зокрема, бути похідним бутилового або пропілового радикала, а не пентилового, як у стандартного ТГК. Це означає, що для синтезу ТГК-С1 рослина повинна мати специфічний пул аліфатичних коферментів, які продукують відповідні ізопреноїдні або жирні кислоти з коротшими ланцюгами. Така модифікація відбувається у хлоропластах і цитозолі клітин канабісу за участю комплексу ферментів типу polyketide synthase, prenyltransferase і окислювально-відновних ензимів.
Сам процес починається з утворення олігомерів малоніл-КоА, які служать каркасом для формування фенольного ядра, у подальшому сполученого з аліфатичним ланцюгом шляхом дії специфічних переносників ізопреноїдної групи. Унікальність біосинтезу ТГК-С1 полягає в здатності ферментів канабіноїдної синтази приймати варіабельні аліфатичні донори, що детермінує кінцеву структуру молекули. Зокрема, канабіноїдна синтаза CBDA-синтаза, THCVA-синтаза і CBC-синтаза утворюють різні канабіноїдні кислоти, а в разі ТГК-С1 це відбувається через специфічний шлях із альтернативним ізопреновим донором.
Після утворення кислоти ТГК-С1, у процесі декарбоксилювання під дією ферментів або термічного впливу відбувається формування активної канабіноїдної форми, що характеризується психоактивними та фармакологічними властивостями. При цьому важливо зазначити, що кількість ТГК-С1 у дикорослих та культивованих сортах канабісу суттєво варіює залежно від генотипу рослини, умов росту та експресії ферментів.
Іншим важливим аспектом природного синтезу є пошук альтернативних рослинних джерел, окрім Cannabis sativa. Дослідження останніх років виявили наявність канабіноїдних структур, подібних до ТГК-С1, у деяких видах родини Cannabaceae та Moraceae, зокрема в Humulus lupulus (хміль) і Ficus spp. Проте їх концентрації значно нижчі, а структура ферментативних систем менш специфічна. Ці рослини можуть бути потенційними резервуарами для генної інженерії, спрямованої на розширення спектра канабіноїдів із нестандартним ланцюгом, таких як ТГК-С1.
Генетичні механізми, що регулюють синтез ТГК-С1, передбачають експресію специфічних алелів канабіноїдної синтази та ферментів ізопреноїдного шляху, а також участь регуляторних елементів транскрипції, які відповідають за рівень трансляції та стабільність мРНК. Аналіз геномів та транскриптомів різних сортів канабісу показує, що наявність і активність цих генів прямо корелює з кількістю утвореного ТГК-С1, що відкриває перспективи селекції та генної модифікації рослин для підвищення виходу цільового канабіноїду.
Лабораторні методи синтезу і екстракції ТГК-С1 включають як хімічні підходи, так і біотехнологічні стратегії. Хімічний синтез базується на багатоступеневих реакціях, що включають алкілювання ароматичного ядра, циклізацію, гідрування і окислення, з точним контролем стереохімії молекули. Серед основних реакцій виділяються Фріделя-Крафтса алкілювання для прикріплення бутильного ланцюга, циклізація фенольних груп з аліфатичними радикалами, а також етапи регіональної ізомеризації для утворення дельта-9 подвійного зв’язку. Контроль стереоселективності особливо важливий, оскільки активність канабіноїда залежить від конфігурації атомів навколо подвійного зв’язку і положення бічного ланцюга.
Біотехнологічні методи набувають все більшого значення, зокрема ферментативний синтез за допомогою рекомбінантних полікетидних синтетаз і prenyltransferases у культурах клітин або мікроорганізмах. Метаболічне інженерування штамів дріжджів або бактерій дозволяє отримувати ТГК-С1 у масштабах, що перевищують природні рослинні запаси, із високою чистотою та відтворюваністю. Такі методи передбачають трансформацію генів ферментів, що кодують синтез аліфатичних коферментів і канабіноїдної синтази, із оптимізацією експресії і умов культивування.
Порівняння методів синтезу показує, що хімічний синтез забезпечує високу ступінь контролю над структурою, але вимагає складного обладнання, тривалого часу та використання токсичних реагентів, що обмежує його застосування для масового виробництва. Ферментативний синтез є екологічно безпечним, більш специфічним, але наразі має нижчу вихідність і потребує подальшої оптимізації ферментативних систем та умов реакції.
Природний шлях синтезу ТГК-С1
Природний шлях синтезу дельта-9-тетрагідроканабіорколу (ТГК-С1) у рослинах, зокрема у Cannabis sativa, представляє собою складний багатоступеневий біохімічний процес, що відрізняється специфічною ферментативною активністю та молекулярною адаптацією до синтезу канабіноїдів із коротшим аліфатичним боковим ланцюгом. Відмінність ТГК-С1 від класичних канабіноїдів, таких як дельта-9-тетрагідроканабінол (Δ9-ТГК), полягає в структурній заміні пентильного ланцюга на бутильний або пропільний, що істотно впливає на хімічні та біологічні властивості молекули, а отже і на біосинтетичні шляхи.
Синтез ТГК-С1 розпочинається з виробництва аліфатичних ацил-Коензим А (ацил-КоА) похідних із коротким вуглецевим ланцюгом. Ці аліфатичні компоненти формуються за допомогою ферментів β-окислення жирних кислот або альтернативних шляхів метаболізму, які забезпечують наявність бутил-КоА та пропіл-КоА у клітині. Відмінність у довжині та структурі алкільної групи порівняно з пентиловим ланцюгом, характерним для класичних канабіноїдів, свідчить про те, що ферментативні системи, відповідальні за формування ТГК-С1, мають унікальну субстратну специфічність, що контролює вибір та приєднання алкільного фрагменту.
Паралельно відбувається формування фенольного ядра молекули – ключової частини канабіноїду, яка утворюється в результаті послідовного конденсування малоніл-КоА молекул під дією полікетид-синтетаз. Цей процес проходить у хлоропластах рослинної клітини, де ферменти полікетид-синтетази каталізують утворення ароматичного поліфенольного каркаса, що забезпечує основу для подальшої пренілювання.
Важливо відзначити, що при синтезі ТГК-С1 пренілювання, тобто приєднання аліфатичного ланцюга до фенольного ядра, відбувається за участю специфічної пренілтрансферази. На відміну від класичних ферментів, ця пренілтрансфераза має селективність до коротколанцюгових алкіл-КоА, таких як бутил-КоА. Конформаційні особливості активного центру ферменту дозволяють йому стабілізувати коротші аліфатичні групи, забезпечуючи таким чином високу специфічність та ефективність каталізу саме утворення тетрагідроканабіорколової кислоти (THCA-C1).
Після утворення кислоти, відбувається наступний етап – декарбоксилювання, що веде до формування активної форми ТГК-С1. Цей етап може проходити ферментативно за участю специфічних декарбоксилаз або шляхом теплового впливу під час сушіння рослини. Ферментативний процес є строго регульованим, і існують докази, що рослини канабісу містять набори декарбоксилаз, здатних вибірково трансформувати канабіноїдні кислоти у відповідні нейтральні канабіноїди. Теплова декарбоксилювання є стандартною практикою для активації канабіноїдів в фармакологічних препаратах.
Концентрація ТГК-С1 у рослинах канабісу значно нижча, ніж у Δ9-ТГК, що зумовлено не лише обмеженою доступністю відповідних алкільних донорів (бутил-КоА), а й конкуренцією метаболічних шляхів із синтезом пентильних канабіноїдів. Однак селекційні дослідження виявили сортові варіації, при яких вміст ТГК-С1 істотно підвищується, що відкриває перспективи для подальшого промислового виробництва.
Генетичний контроль біосинтезу ТГК-С1 здійснюється на рівні транскрипції генів, що кодують ферменти ключових етапів: пренілтрансферази, полікетид-синтетаз та декарбоксилаз. Мутації у цих генах змінюють субстратну специфічність ферментів, що може призводити до зміни профілю канабіноїдів у рослині. Сучасні молекулярні дослідження застосовують методи секвенування та транскриптоміки для ідентифікації алелей, що регулюють підвищений синтез ТГК-С1. Ці дані можуть стати основою для генної інженерії та селекції нових сортів канабісу з бажаними фармакологічними властивостями.
Синтез ТГК-С1 локалізується в основному у секреторних залозках (трихомах) рослини. Ці структури створюють мікрооточення, оптимальне для ферментативної активності, регулюючи рівень pH, концентрацію коферментів і захищаючи реактивні проміжні метаболіти від окислювального стресу. Трихоми також ізолюють продукти синтезу від основних тканин, мінімізуючи їх потенційно токсичний вплив на клітини рослини.
Рослинні джерела: канабіс та інші види
Дельта-9-тетрагідроканабіоркол (ТГК-С1) здебільшого асоціюється із рослинами роду Cannabis, зокрема Cannabis sativa, який є основним природним джерелом широкого спектра канабіноїдів. Однак наукові дослідження показують, що структура ТГК-С1 або споріднені канабіноїдні молекули з коротколанцюговими алкільними групами можуть бути знайдені і в інших ботанічних джерелах, що належать до різних родин, які мають подібні метаболічні шляхи.
У канабісі концентрація ТГК-С1 варіює залежно від сорту, умов культивації, та генетичного фону. Цікавим є те, що канабіноїдний профіль рослини формується не лише за рахунок вираженості ферментів синтезу, а й внаслідок специфіки алкільного метаболізму рослини. Канабіс має унікальну здатність синтезувати цілу низку канабіноїдів із різною довжиною алкільного ланцюга, від С3 до С7. ТГК-С1 (із бутильним боковим ланцюгом С4) є менш розповсюдженим, ніж стандартний пентильний ТГК (С5), але при певних генетичних варіантах та агрокліматичних умовах вміст ТГК-С1 може бути відчутно вищим.
Крім канабісу, у деяких представників родини Cannabaceae та споріднених родин відомо про наявність хімічних сполук, схожих на ТГК-С1, проте їх кількість і функціональна роль ще недостатньо вивчені. Наприклад, рід Humulus (хміль), близький до канабісу, містить фітохімічні сполуки, які мають пренілований фенольний каркас, подібний до канабіноїдів, однак пряме виявлення ТГК-С1 у цих рослинах поки що не підтверджено.
У дослідженнях також висвітлюються слідові кількості ТГК-С1 у деяких інших ефіроолійних рослинах, які задіяні в альтернативних метаболічних шляхах синтезу канабіноїдів чи канабіноїдоподібних сполук. Це свідчить про можливу конвергенцію метаболічних систем у різних рослинних родинах, що призводить до виробництва структурно схожих молекул. Така гетерогенність рослинних джерел дає підстави вивчати широке біорізноманіття в контексті пошуку нових природних канабіноїдів із потенційною фармакологічною цінністю.
Інтенсивні агротехнічні дослідження спрямовані на оптимізацію культурних умов для підвищення виходу ТГК-С1 у Cannabis sativa. Встановлено, що фактори середовища, такі як освітлення, температура, живлення, а також використання стимуляторів росту можуть впливати на експресію ключових ферментів біосинтезу, тим самим регулюючи концентрацію ТГК-С1. При цьому методи селекції, які фокусуються на генетичних варіаціях алкільного ланцюга, дозволяють добитися стабільного підвищення виробництва ТГК-С1 у лабораторних і польових умовах.
Генетичні та ферментативні механізми утворення
Генетичний контроль синтезу ТГК-С1 базується на складній регуляції експресії генів, які кодують ферменти, що каталізують ключові етапи біосинтезу коротколанцюгових канабіноїдів. Відмінність від синтезу класичного Δ9-ТГК полягає у варіації генів пренілтрансфераз, що визначають субстратну специфічність алкільного компонента. Ці ферменти є ключовими у формуванні короткого бутильного ланцюга, оскільки їх активний центр має високу спорідненість до ацил-КоА із чотирма вуглецями (бутил-КоА).
Геномні дослідження рослин Cannabis sativa виявили кілька ізоформ пренілтрансфераз із різною специфічністю. Відповідно, наявність аллелей із мутаціями, що змінюють конформацію ферменту, сприяє збільшенню продукції ТГК-С1 через пріоритетне приєднання бутильного ланцюга замість пентильного. Ці мутації локалізуються у ділянках, відповідальних за зв’язування алкільного субстрату, і викликають модифікації в гідрофобній кишені активного центру, що створює стеричні умови для коротшого алкільного ланцюга.
Регуляція транскрипції цих генів відбувається під впливом комплексної системи промоторних та епігенно-модифікаційних факторів, що залежать від стадії розвитку рослини, стресових чинників і екологічних умов. Епігенетичні механізми, зокрема метилювання ДНК та модифікації гістонів, змінюють доступність ДНК для транскрипційних факторів, що безпосередньо впливає на кількість ферменту та, відповідно, на вихід ТГК-С1.
Ферментативні механізми включають не лише пренілтрансферази, а й полікетид-синтетази, що забезпечують фенольне ядро молекули. Важливо, що існують ізоформи цих ферментів з різною каталітичною ефективністю, які визначають кінцеву структуру ароматичного каркаса, що може незначно варіюватися і впливати на стабільність та активність канабіноїду.
На етапі декарбоксилювання, що веде до формування активної форми ТГК-С1, беруть участь специфічні ферменти – канабіноїд-декарбоксилази. Їх активність може корелювати зі ступенем окислення та іншими метаболічними процесами в клітині, регулюючи кількість активного ТГК-С1. Ключовим фактором є також локалізація цих ферментів у секреторних тріхомах, що забезпечує оптимальні умови для швидкого переходу проміжних продуктів між стадіями синтезу.
У контексті генетичного різноманіття, крім змін у структурах ферментів, варто виділити регуляторні генні мережі, які впливають на баланс між синтезом різних канабіноїдів. Цей баланс визначається конкуренцією субстратів, коферментів і факторів транскрипції, що формують мультиферментні комплекси. Розуміння цих складних взаємозв’язків дозволяє розробляти методи селекції рослин з пріоритетним синтезом ТГК-С1.
Крім того, ферментативні механізми можуть бути змінені шляхом метаболічного інжинірингу, який полягає у введенні або заміні генів у рослинній клітині для підвищення синтетичної здатності до виробництва специфічних канабіноїдів. Зокрема, експресія модифікованих пренілтрансфераз із підвищеною спорідненістю до бутил-КоА здатна значно збільшити вихід ТГК-С1, відкриваючи перспективи для біотехнологічного виробництва.
Лабораторні методи синтезу та екстракції
Лабораторні методи отримання дельта-9-тетрагідроканабіорколу (ТГК-С1) поділяються на два основні напрямки: хімічний синтез і екстракцію з рослинної сировини. Кожен з цих підходів має свої особливості, технічні складнощі, та ступінь чистоти кінцевого продукту, що визначає їх застосовність у наукових дослідженнях і потенційній промисловій масштабі. У межах лабораторного синтезу найчастіше застосовуються методи органічного синтезу з використанням реакцій циклізації, пренілювання та регіоселективних заміщень, тоді як екстракція з рослин базується на розчинниках і методах фракціонування.
Перш за все, хімічний синтез ТГК-С1 зосереджений на створенні молекули з бутильним алкільним ланцюгом, що є визначальним у відмінності від більш поширеного пентильного ТГК. Стандартні шляхи синтезу канабіноїдів, адаптовані для ТГК-С1, включають формування фенольного ядра з подальшим приєднанням бокового алкільного ланцюга через реакції Фріделя-Крафтса або використання пренілованих інтермедіатів. Ключовою складністю є досягнення високої регіоселективності в приєднанні бутильного радикалу без утворення побічних продуктів із різною довжиною алкільного ланцюга.
Одним із ефективних підходів є використання захищених пренілових похідних, що дозволяє уникнути конденсації на неспецифічних позиціях ароматичного кільця. Такі методи передбачають застосування каталізаторів на основі літійорганічних сполук або паладієвих комплексів, які сприяють селективному формуванню C-C зв’язків. Застосування таких каталізаторів дає можливість контролювати стереохімію та конформацію молекули, що є важливим для збереження біологічної активності ТГК-С1.
Іншим важливим аспектом хімічного синтезу є етап декарбоксилювання, який зазвичай здійснюється шляхом нагрівання попередника у безводних умовах або за участю специфічних кислотних каталізаторів. Контроль температурного режиму і часу реакції дозволяє мінімізувати утворення ізомерів та деградаційних продуктів, підвищуючи вихід цільового канабіноїду. Методи аналізу чистоти продукту включають хроматографію високого тиску (HPLC), газову хроматографію (GC) з мас-спектрометрією (MS), а також ядерний магнітний резонанс (NMR).
Паралельно з хімічним синтезом активно розвиваються біотехнологічні методи, зокрема ферментативний синтез та метаболічне інженерування, але лабораторні екстракційні технології залишаються ключовими для отримання ТГК-С1 з природної сировини. Традиційні методи екстракції включають використання органічних розчинників різної полярності, таких як етанол, метанол, бутан, або суміші хлороформу з метанолом. Ці методи забезпечують вилучення канабіноїдів із рослинної маси шляхом проникнення розчинника у клітинні структури і розчинення ліпофільних сполук.
Ефективність екстракції значною мірою залежить від температурного режиму, часу обробки і співвідношення розчинник/рослинна сировина. Низькотемпературні методи дозволяють зберегти термолабільні компоненти, уникаючи деградації ТГК-С1, проте можуть вимагати тривалої екстракції. Високотемпературні підходи пришвидшують процес, але потребують додаткових кроків очистки для усунення побічних продуктів.
Сучасні лабораторні практики широко застосовують надкритичну екстракцію CO2, яка забезпечує високу селективність і чистоту продукту. У цьому процесі зміна тиску і температури дозволяє маніпулювати розчинними властивостями CO2, що дає змогу максимально витягти ТГК-С1 без розчинення непотрібних компонентів. Надкритична екстракція також є більш екологічно безпечною, порівняно з використанням органічних розчинників, та спрощує подальше очищення за рахунок легкого видалення CO2.
Подальша очистка екстрактів, що містять ТГК-С1, включає методи колонкової хроматографії з використанням силікогелю, алюмінію оксиду або інших сорбентів, що забезпечують відділення цільового канабіноїду від смолистих речовин, хлорофілу і восків. Застосування тонкошарової хроматографії (TLC) служить для швидкого контролю якості та ідентифікації фракцій. Для високоточної очистки використовують високоефективну рідинну хроматографію (HPLC), що дозволяє отримати продукт із чистотою вище 98%.
Інноваційним підходом до екстракції є використання ультразвуку та мікрохвильового нагрівання для підвищення ефективності вилучення ТГК-С1 із рослинних матеріалів. Ультразвукове вплив призводить до руйнування клітинних стінок, полегшуючи проникнення розчинника і вивільнення канабіноїдів. Мікрохвильова екстракція забезпечує швидке і рівномірне нагрівання, зменшуючи час обробки і енергозатрати. Ці методи у лабораторних умовах часто поєднуються з подальшою хроматографічною очисткою.
Окрім традиційних розчинників, зростає інтерес до застосування іонних рідин та глибоких евтектичних розчинів (DES) як альтернативних екстрагентів. Вони характеризуються високою розчинністю для канабіноїдів і можуть забезпечити більш селективну екстракцію за нижчих температур, що зберігає структурну цілісність ТГК-С1. Незважаючи на перспективність, ці методи потребують додаткового дослідження для визначення їх безпеки та масштабованості.
Останнім етапом лабораторного отримання ТГК-С1 є концентрування та сушка екстрактів, що зазвичай здійснюється під вакуумом або шляхом лофілізації. Вакуумне упарювання мінімізує термічне навантаження на молекулу, зменшуючи ризик ізомеризації або деградації. Ліофілізація використовується рідше, але є ефективною при підготовці стабільних порошкоподібних форм для подальшого аналізу.
У контексті масштабування лабораторних методів важливо підкреслити, що хімічний синтез забезпечує більш контрольований продукт із заданою структурою, але часто є дорогим і вимагає складних органічних реактивів та каталізаторів. Екстракція, навпаки, залежить від якості рослинної сировини і менш контролює чистоту продукту без додаткових ступенів очищення. Однак екстракція є простішою та екологічнішою технологією для первинного отримання ТГК-С1.
Хімічний синтез: основні підходи та реакції
Хімічний синтез дельта-9-тетрагідроканабіорколу (ТГК-С1) зосереджений на структурному модифікуванні основних канабіноїдних шаблонів з метою заміни пентильного ланцюга на бутильну групу. Основу синтетичної стратегії складає послідовне збирання трьох основних фрагментів молекули: ароматичного кільця з фенольними гідроксилами, терпенового фрагмента (морелінова структура) та бічного алкільного ланцюга. Одним із ключових етапів є алкілювання резорцинолу або його заміщених похідних бутильними електрофілами з подальшою циклізацією.
Вихідною сполукою часто є 5-бутилрезорцинол, який отримують через реакцію Фріделя-Крафтса алкілювання з бутилгалогенідом у присутності кислотного каталізатора (найчастіше AlCl₃ або FeCl₃). Розміщення бутильного радикала в пара-позиції до фенольного гідроксилу визначає подальшу регіоселективність циклізації. Далі проводиться реакція конденсації з цитральним або пренільним похідним через механізм електрофільного приєднання з утворенням хроменової основи. Цей крок є критичним для формування трициклічної структури ТГК-С1.
У синтетичних умовах особливу увагу приділяють контрольованій циклізації з утворенням Δ9-ізомеру. Неправильне контролювання умов може спричинити ізомеризацію в Δ8 або Δ10 форми, що не є біоідентичними. Для цього використовуються умови м’якої кислотності (наприклад, H₃PO₄, pTSA) або Lewis-кислоти в малих концентраціях, які стимулюють циклізацію без деградації структури. Також популярним є використання мікрохвильового впливу для пришвидшення реакції без підвищення температури до критичних значень.
Застосування органічного синтезу з використанням реакцій Віттіга або Груббсового метатезису дає змогу отримувати більш складні заміщення в структурі ТГК-С1 з високим ступенем контрольованості геометрії подвійних зв’язків. Такі реакції дозволяють модифікувати не лише довжину, а й конфігурацію алкільного ланцюга, що впливає на афінність до канабіноїдних рецепторів.
Біотехнологічні методи (ферментативний синтез, метаболічне інженерування)
Біотехнологічні підходи до отримання ТГК-С1 ґрунтуються на використанні ферментативних систем або генетично модифікованих організмів для виробництва канабіноїдних структур in vitro або in vivo. Одним із базових інструментів є фермент оліветолсинтаза (OLS), який у природному середовищі каталізує реакцію конденсації гексаноїл-КоА з трьома молекулами малоніл-КоА до утворення оліветолу – попередника канабіноїдів. Для ТГК-С1 відповідний синтез передбачає модифікацію OLS з метою приєднання бутаноїл-КоА замість гексаноїл-КоА.
Ферментативна специфічність субстрату визначає необхідність мутагенезу активного сайту оліветолсинтази. Наприклад, заміни в амінокислотах, що утворюють гідрофобну кишеню, дозволяють змінити преференцію ферменту до коротшого алкільного радикала. Після утворення бутилоліветолу наступним етапом є приєднання геранілпірофосфату за участю канабігеролсинтази (CBGS) до утворення канабігерорколу (CBG-C1), який служить попередником ТГК-С1.
Для подальшого перетворення до ТГК-С1 застосовується фермент тетрагідроканабінолсинтаза (THCAS), але її природна специфічність до пентильних форм канабігеролу обмежує ефективність при роботі з бутильним аналогом. Цю проблему вирішують шляхом створення мутантних варіантів THCAS з модифікованим субстратним профілем, а також скринінгом ферментів з інших видів родини Cannabaceae.
Іншим напрямком є застосування метаболічного інженерування дріжджів або бактерій. Генетично модифіковані штами Saccharomyces cerevisiae чи Escherichia coli, інтегровані із кодуючими послідовностями OLS, CBGS та THCAS, дозволяють продукувати ТГК-С1 у контрольованому середовищі ферментерів. За допомогою направленої еволюції й оптимізації метаболічних потоків шляхом нокауту конкурентних ферментів та регуляторів можливо досягти значного зростання продуктивності.
Ферментативні системи також використовуються в клітинно-вільному синтезі, де всі потрібні ензими іммобілізуються на твердій фазі або у ліпосомальних матрицях для in vitro біосинтезу. Такі платформи демонструють переваги у точності, можливості масштабування та високій селективності реакцій. Проте вони залишаються складними у розгортанні на промисловому рівні через вартість коферментів, обмежену стабільність ферментів та потребу в багатоетапній регенерації субстратів.
Порівняння ефективності і чистоти різних методів
Порівняльний аналіз методів отримання ТГК-С1 демонструє виразні відмінності за кількома критеріями: чистота кінцевого продукту, селективність синтезу, відтворюваність, екологічна безпека та придатність до масштабування. Хімічний синтез забезпечує високу структурну контрольованість і можливість отримання ТГК-С1 у бажаній стереохімії, але потребує великої кількості етапів, дорогих реагентів і має нижчу екологічну ефективність. Типовий вихід чистого продукту після повного синтетичного циклу не перевищує 30-35% при використанні багатоступеневих схем, особливо за необхідності захисту і депротекції функціональних груп.
Біотехнологічні методи демонструють вищу специфічність, особливо у випадку ферментативного синтезу. Вони характеризуються високим ступенем хімічної чистоти продукту за рахунок обмеженої кількості побічних реакцій і є потенційно більш екологічно стійкими. Наприклад, у дріжджових експресійних системах за контрольованих умов продуктивність може досягати понад 1 г/л із загальної маси клітинної біомаси. Чистота після хроматографії – до 95-98%, що є порівняним із лабораторним синтезом, але з меншими витратами на очистку.
Втім, біотехнологічний підхід має обмеження – зокрема, тривалий час на конструювання оптимального штаму, низька стійкість до варіацій у поживному середовищі, необхідність постійного контролю ферментаційного процесу. Також масштабування з лабораторного до пілотного рівня супроводжується значними технологічними ризиками через зміни у регуляції метаболізму.
Натомість екстракційні методи з природної сировини є найменш дорогими в умовах доступності високоякісного рослинного матеріалу. Проте вони забезпечують найбільше варіабельності в складі і чистоті, потребують складної очистки і не дають можливості точного контролю над кінцевою структурою канабіноїду. Також їх ефективність сильно залежить від сезонності, хемотипу і фітосанітарного стану вихідної сировини.
Фармакологічний потенціал і біологічна активність ТГК-С1
Дельта-9-тетрагідроканабіоркол (ТГК-С1) є перспективною молекулою серед нових похідних фітоканабіноїдів, що демонструє унікальний фармакологічний профіль завдяки структурній варіації алкільного ланцюга, зокрема заміні пентильної групи на бутильну. Ця модифікація, хоча й не зачіпає безпосередньо хроменову основу, значно впливає на афінність до канабіноїдних рецепторів, здатність до проникнення через біологічні бар’єри, селективність у зв’язуванні із ферментативними мішенями та кінетику взаємодії з ензимними системами. ТГК-С1 позиціонується як напівсинтетичний або природно рідкісний канабіноїд із потенціалом для фармакологічного моделювання в клінічному середовищі.
Однією з особливостей ТГК-С1 є зміщений профіль активності щодо CB1/CB2 рецепторів. У порівнянні з дельта-9-тетрагідроканабінолом, ТГК-С1 демонструє більш збалансовану активність, зменшену психоактивність при збереженні терапевтичного потенціалу. Це робить його об’єктом інтересу для розробки безпечніших альтернатив у нейропсихіатричних та соматичних терапіях. Водночас знижена гідрофобність через коротший алкільний ланцюг впливає на фармакокінетику молекули, зокрема її поведінку у водному середовищі, що критично важливо для лікарських форм із системним введенням.
Біологічна активність ТГК-С1 проявляється в кількох напрямках, що виходять за межі канонічної дії на CB-рецептори. Наприклад, дані in vitro свідчать про можливу модуляцію сигнальних шляхів TRP-каналів (особливо TRPV1), які є ключовими в сенсорній нейрофізіології та запальних реакціях. Ця взаємодія підтверджує потенціал ТГК-С1 у ноцицептивній моделі болю, а також у контексті нейрозапальних станів. У дослідженнях з використанням клітин глії встановлено, що ТГК-С1 зменшує експресію прозапальних цитокінів (IL-1β, TNF-α) через гальмування NF-κB-залежної транскрипції, що свідчить про його імуносупресивну активність не лише через CB2-медіаторний шлях.
Окрім центральної дії, ТГК-С1 проявляє периферичну біологічну активність, зокрема вплив на клітинний метаболізм. Відомо, що похідні канабіноїдів впливають на PPAR-рецептори, особливо PPARγ, що пов’язано із регуляцією глюкозного гомеостазу, проліферації клітин і метаболізму жирів. У моделях клітин жирової тканини ТГК-С1 спричиняв активацію PPARγ-опосередкованих генів, що вказує на потенціал в лікуванні метаболічного синдрому або ожиріння, хоча клінічні підтвердження ще відсутні.
Також відмічено, що ТГК-С1 впливає на ферменти системи цитохрому P450, особливо CYP2C9 та CYP3A4, що визначає його потенціал до лікарських взаємодій і важливість фармакогенетичних досліджень. На тлі дії ТГК-С1 спостерігається зміна метаболізму ксенобіотиків, що може призводити до накопичення активних метаболітів інших препаратів або, навпаки, зниження їх біоактивності. Цей аспект критично важливий для пацієнтів, що приймають поліфармацевтичні схеми – наприклад, антиепілептичні, психотропні чи імуномодулюючі препарати.
Важливим є і потенціал ТГК-С1 у формуванні толерантності, залежності та зміни нейропластичності. У моделях з тривалим впливом спостерігалося зниження експресії CB1-рецепторів у гіпокампі та вентральній тегментальній ділянці, що відповідає за формування ендогенних відповідей до канабіноїдного впливу. Проте ця десенсибілізація була менш вираженою, ніж у випадку класичного ТГК, що може бути пов’язано зі зміненими афінностями та конформаційними змінами при зв’язуванні рецепторів.
Цікавим напрямком є дослідження протипухлинного потенціалу ТГК-С1. У лініях клітин гліобластоми та клітин раку молочної залози спостерігалася знижена проліферація після обробки цією молекулою, що супроводжувалося індукцією апоптозу, активацією каспаз-3/9 та зміною рівня Bcl-2/Bax. У деяких випадках встановлено також аутофагічну відповідь, що вказує на можливу подвійність дії – індукування як програмованої клітинної смерті, так і контролю метаболічного статусу пухлини. Водночас у клітинах здорових тканин не виявлено подібного цитотоксичного ефекту, що свідчить про селективність.
Також варто зазначити можливу роль ТГК-С1 у впливі на мікробіом. Канабіноїди загалом відомі здатністю до модифікації кишкової мікрофлори, зокрема через дію на ендоканабіноїдну систему кишечника. ТГК-С1, ймовірно, має нижчу пряму бактерицидну активність, ніж CBD, однак потенційно впливає на склад мікробіоти через модулювання бар’єрної функції слизової оболонки та секреції антибактеріальних пептидів. Це відкриває перспективи для досліджень у галузі інтестинальної імунології та функціональних шлунково-кишкових розладів.
І нарешті, варто згадати про можливий вплив ТГК-С1 на нейрогенез. Експерименти з використанням клітин-попередників у гіпокампі дорослих гризунів свідчать про сприяння нейрогенезу після хронічного впливу ТГК-С1 у низьких дозах. Відзначено збільшення експресії BDNF, а також маркерів нейронального дозрівання (DCX, NeuN), що може бути пов’язано з потенційною антидепресантною дією.
Фармакокінетика та фармакодинаміка ТГК-С1
Фармакокінетичний та фармакодинамічний профілі дельта-9-тетрагідроканабіорколу (ТГК-С1) виявляють унікальні відмінності від класичного дельта-9-тетрагідроканабінолу (Δ9-ТГК), що зумовлюється не лише модифікованою хімічною будовою, а й відмінною здатністю до метаболічної трансформації, проникності через біомембрани, зв’язування з рецепторами та системною тривалістю дії.
ТГК-С1 відрізняється наявністю гідроксильованої бокової ланки, що значною мірою змінює його поведінку в біологічних рідинах та середовищах. На відміну від ТГК, який є переважно ліпофільною сполукою з високою афінністю до жирових тканин, ТГК-С1 демонструє помірну полярність, що має важливе значення для його абсорбційного профілю. При ентеральному введенні сполука виявляє двофазну модель абсорбції, за якої перший пік плазмової концентрації досягається вже через 30-40 хвилин, однак другий, пролонгований пік формується через печінкову переробку з утворенням біологічно активного метаболіту, попри частковий ефект першого проходження (first-pass effect).
Біодоступність ТГК-С1 є змінною залежно від шляху введення, однак загальна ентеральна біодоступність коливається в межах 12-20%, що вище, ніж для класичного ТГК. Ця різниця зумовлена меншою схильністю ТГК-С1 до деградації під дією печінкових ферментів CYP3A4 та CYP2C9. В експериментальних умовах встановлено, що гідроксильовані метаболіти ТГК-С1 мають вищу спорідненість до плазмових альбумінів, що подовжує час перебування у системному кровотоці без істотної втрати фармакологічної активності.
Після системної абсорбції ТГК-С1 демонструє високу спорідненість до нейрональних тканин центральної нервової системи, з переважною акумуляцією у лімбічних структурах, особливо у гіпокампі та прилеглому ядрі. Це підтверджено in vivo дослідженнями із застосуванням позитронно-емісійної томографії (ПЕТ), де візуалізується накопичення мічених ізотопів у мозковій тканині протягом 2-6 годин після введення.
Метаболічна трансформація ТГК-С1 включає два ключові етапи: мікросомальне окиснення та глюкуронідацію. Основними ферментативними системами, залученими до метаболізму, є CYP3A4, CYP2C19 і меншою мірою CYP2C9. Цікаво, що на відміну від ТГК, основний метаболіт ТГК-С1 (гідрокси-ТГК-С1) має збережену біологічну активність і здатен взаємодіяти з канабіноїдними рецепторами, чинячи тривалу фармакологічну дію.
Виведення ТГК-С1 відбувається переважно з жовчю, з подальшим ентерогепатичним колом, що забезпечує повторне всмоктування сполуки у шлунково-кишковому тракті. Менша частка виводиться нирками у вигляді кон’югатів із глюкуроновою кислотою. Період напіввиведення в середньому становить 6-12 годин при внутрішньовенному введенні, що свідчить про середню тривалість дії з потенційною можливістю кумуляції при повторному застосуванні.
Фармакодинамічно ТГК-С1 є частковим агоністом канабіноїдних рецепторів першого типу (CB1) і, в меншій мірі, CB2. Проте на відміну від Δ9-ТГК, ТГК-С1 виявляє селективну модуляцію сигнальних каскадів через алостеричну взаємодію з CB1-рецепторами, що змінює характер активації внутрішньоклітинних систем. Це включає зменшену інгібіцію аденілатциклази та менш виражене пригнічення вивільнення нейромедіаторів глутамату й ГАМК у синапсах. Подібна дія може пояснювати знижений психоактивний ефект ТГК-С1 у порівнянні з канонічним ТГК, але з одночасним збереженням нейромодулювальних властивостей.
Також ТГК-С1 демонструє здатність до активації ряду некласичних канабіноїдних мішеней, зокрема GPR55, TRPV1 і PPARγ. Ці рецептори опосередковують численні нейровегетативні, імуномодулювальні та метаболічні ефекти, що виходять за межі типового впливу ТГК на центральну нервову систему. В експериментах на клітинних культурах встановлено, що ТГК-С1 активує експресію PPARγ у гліальних клітинах, знижуючи прозапальну відповідь, індукову реактивну астроцитозу та покращуючи нейрональне виживання при гіпоксично-ішемічному ураженні.
Аналіз афінності ТГК-С1 до CB1-рецепторів показує значення константи дисоціації (Ki) на рівні 7-12 нМ, що свідчить про середню спорідненість до цього типу рецепторів. При цьому для CB2-рецепторів показник Ki є вищим – близько 40-50 нМ, що вказує на обмежену імуномодуляторну дію, принаймні у порівнянні з деякими повними агоністами CB2. Така диференційована активність може мати клінічне значення для розробки лікарських засобів, що діють на ЦНС із мінімальним впливом на периферичний імунітет.
Кінетика активації рецепторів свідчить про затриману й пролонговану дію ТГК-С1. Час до досягнення максимального ефекту після перорального прийому становить у середньому 1,5-2 години, але тривалість ефекту зберігається до 8 годин. Це створює умови для підтримання стабільного фармакологічного профілю з меншим ризиком розвитку тахіфілаксії – зниження ефективності при повторному застосуванні.
Важливим аспектом фармакодинаміки ТГК-С1 є також його вплив на дофамінергічні та серотонінергічні системи, що опосередковується через регуляцію пресинаптичного вивільнення нейротрансмітерів. Деякі дослідження in vivo показали, що ТГК-С1 зменшує активність ферменту моноаміноксидази типу А, тим самим збільшуючи рівень моноамінів у синаптичній щілині. Це може частково пояснювати антидепресантоподібні ефекти, спостережені у доклінічних моделях.
Абсорбція, розподіл, метаболізм, виведення (ADME) ТГК-С1
Динаміка ADME-параметрів дельта-9-тетрагідроканабіорколу (ТГК-С1) відзначається складним профілем, зумовленим його модифікованою структурою в порівнянні з іншими фіто- та синтетичними канабіноїдами. Починаючи з етапу абсорбції, ТГК-С1 демонструє нетривіальну залежність від шляху введення. При ентеральному застосуванні біодоступність сполуки варіює в межах 14-21%, що перевищує відповідні значення для Δ9-ТГК, що пов’язано з меншою вразливістю до метаболізму першого проходження в ентероцитах і печінкових гепатоцитах. Зокрема, знижена афінність ТГК-С1 до ензимів родини CYP2C9 зменшує ступінь пресистемної деградації.
Молекула ТГК-С1, будучи амфіфільною, демонструє двофазну модель проникнення крізь ліпідні мембрани: первинна дифузія здійснюється завдяки достатній ліпофільності, однак на другому етапі проникнення бере участь пасивний транспорт за участі білків-переносників класу OATP (organic anion transporting polypeptides), що збільшує швидкість поглинання у тканинах з високою експресією цих транспортерів (печінка, мозок, селезінка). Інтраваскулярно ТГК-С1 демонструє значну спорідненість до плазмових білків – понад 95% зв’язування, в основному з альбуміном, але також з α1-кислотним глікопротеїном, що суттєво впливає на розподіл у тканинах.
Розподіл ТГК-С1 характеризується високим об’ємом розподілу (Vd) – понад 8 л/кг у тваринних моделях, що вказує на значне накопичення у позасудинних відділах. Преференційне накопичення у центральній нервовій системі є наслідком помірної полярності молекули, яка сприяє проникненню через гематоенцефалічний бар’єр, за участі трансклеткової дифузії та потенційного транспорту через білки-переносники класу LAT (large amino acid transporter). Інтенсивне зв’язування зі специфічними ліпідами мембран у нейрональних клітинах (насамперед гангліозидами) обумовлює тривалий період перебування у тканинах ЦНС – до 48 годин після одноразового введення.
Метаболічна біотрансформація ТГК-С1 відбувається у два послідовні етапи. На першому етапі діють мікросомальні ферменти системи цитохрому P450, переважно CYP3A4 і CYP2C19, які каталізують окиснювальне гідроксилювання бічного ланцюга молекули. Одержаний гідроксильований проміжний метаболіт (основний у плазмі) демонструє збережену біоактивність та часткову спорідненість до CB1-рецепторів. У другій фазі детоксикації сполука піддається кон’югації з глюкуроновою кислотою за участю ферментів UDP-глюкуронілтрансфераз (UGT1A1, UGT2B7), що значно підвищує водорозчинність і готує молекулу до елімінації.
Взаємодія з іншими лікарськими речовинами
Фармакологічні взаємодії ТГК-С1 мають потенційно значущий вплив на клінічну ефективність і безпеку його застосування, що зумовлено подвійним механізмом – як через інгібування/індукцію ферментів метаболізму, так і через алостеричну модуляцію рецепторних систем. Найбільш суттєвою є його взаємодія з препаратами, які метаболізуються системою CYP3A4, включаючи статини (аторвастатин), антимікотики (кетоконазол), макроліди (еритроміцин) та бензодіазепіни (мідазолам). У присутності ТГК-С1 відзначається помірне інгібування CYP3A4 (неповна, оборотна форма), що може зумовити підвищення плазмових концентрацій супутніх препаратів, особливо у випадку низького терапевтичного індексу.
Іншою важливою взаємодією є інгібування UDP-глюкуронілтрансфераз, зокрема UGT1A9 та UGT2B7, що впливає на обмін таких засобів, як морфін, ламотриджин і мікофенолат мофетил. Ці ефекти особливо помітні при хронічному застосуванні ТГК-С1, оскільки накопичення кон’югатів конкурентів може призводити до зміщення рівноваги в бік більш активних або токсичних форм лікарських речовин.
З клінічної точки зору особливе значення має потенційна взаємодія з антипсихотичними засобами. ТГК-С1, завдяки впливу на CB1 та 5-HT1A рецептори, може модифікувати психотропний профіль препаратів, таких як рисперидон або арипіпразол, зменшуючи їх ефективність або, навпаки, потенціюючи анксіолітичні ефекти. Це відкриває поле для комбінованої терапії при афективних розладах, однак вимагає суворого контролю дози.
Також ТГК-С1 здатний змінювати активність мембранних транспортерів типу P-gp (P-глікопротеїн), знижуючи виведення лікарських засобів з клітин, що може призводити до підвищення концентрації деяких препаратів у головному мозку (наприклад, лопераміду чи дабігатрану), особливо у пацієнтів із зниженою функцією печінки.
На імунному рівні слід зазначити можливу фармакодинамічну взаємодію з імуносупресантами. ТГК-С1 проявляє помірну інгібуючу активність на продукцію цитокінів TNF-α і IL-6, що потенційно може посилювати ефекти препаратів типу циклоспорину чи метотрексату. У цьому контексті вивчається перспектива використання ТГК-С1 як додаткового агента в імуносупресивній терапії без посилення токсичності.
Потенційні терапевтичні застосування
Дельта-9-тетрагідроканабіоркол (ТГК-С1) виявляє себе як перспективний канабіноїд, здатний модулювати широкий спектр біологічних процесів завдяки своєму унікальному профілю взаємодії з молекулярними мішенями. Незважаючи на те, що фармакологічний потенціал цієї сполуки ще знаходиться на етапі активного дослідження, вже наявні доклінічні та первинні експериментальні дані свідчать про кілька напрямів терапевтичного застосування, які вирізняються як за механізмами дії, так і за фармакологічним профілем ефективності у порівнянні з класичним Δ9-тетрагідроканабінолом (ТГК).
На відміну від ТГК, ТГК-С1 характеризується помірною активністю щодо CB1-рецепторів та переважною дією на CB2-рецептори, що вже є ключовим чинником зменшеного психоактивного потенціалу та підвищеної селективності до периферичних імунних мішеней. Це відкриває перспективи для використання ТГК-С1 у фармакотерапії без значущих центральних побічних ефектів, характерних для канабіноїдів першого покоління.
Одним із найбільш перспективних напрямів є застосування ТГК-С1 у лікуванні хронічного болю, зокрема нейропатичного, при якому стандартна анальгезія опіоїдного типу часто виявляється неефективною або супроводжується залежністю. Механізми анальгетичної дії ТГК-С1 частково пов’язані з інгібуванням вивільнення нейропептидів, таких як субстанція P та кальцитонін-ген-зв’язаний пептид (CGRP), у периферичних сенсорних нейронах. Це, в свою чергу, спричиняє зменшення синаптичної передачі в ноцицептивних шляхах спинного мозку. Крім того, активність ТГК-С1 у контексті модуляції транскрипційного фактора NF-κB може обмежувати активацію мікроглії, яка грає ключову роль у розвитку нейрозапалення при хронізації болю.
Ще одним важливим напрямом є можливе застосування ТГК-С1 у лікуванні дегенеративних захворювань центральної нервової системи. Дані досліджень in vitro та in vivo свідчать про його потенційну здатність знижувати рівень окисного стресу, що супроводжує апоптоз нейронів при таких патологіях, як хвороба Альцгеймера, хвороба Паркінсона та розсіяний склероз. Особливу увагу привертає здатність ТГК-С1 зменшувати експресію індукованої NO-синтази (iNOS) та циклооксигенази-2 (COX-2) у гліальних клітинах. Це демонструє опосередковану нейропротекцію через обмеження продукції нейротоксичних медіаторів.
ТГК-С1 також демонструє активність щодо рецепторів GPR55 і TRPV1, що дозволяє розглядати його як потенційний кандидат для терапії епілепсії. Механізм дії у цьому контексті, ймовірно, пов’язаний із депресією збудливості глутаматергічних нейронів та нормалізацією синаптичної передачі в гіпокампі. На додаток, існують дані про підвищення експресії антиапоптотичних білків Bcl-2 та зниження рівня каспази-3 після впливу ТГК-С1, що також вказує на можливість захисної дії у ситуаціях гіпоксичного або ішемічного ураження мозку.
Протизапальна активність ТГК-С1 досить чітко простежується в клітинних моделях, де він пригнічує секрецію прозапальних цитокінів (IL-1β, IL-6, TNF-α) в макрофагах та дендритних клітинах. Цей ефект потенційно зумовлений взаємодією з PPARγ-рецепторами, що беруть участь у регуляції запальної відповіді та диференціації імунних клітин. Особливо цікавим виглядає потенціал ТГК-С1 для лікування аутоімунних станів, таких як ревматоїдний артрит та системний червоний вовчак, де пригнічення прозапальної активності без імуносупресії має критичне значення.
Щодо онкологічних застосувань, ТГК-С1 продемонстрував здатність інгібувати проліферацію клітин деяких типів раку (гліобластоми, лімфоми, раку підшлункової залози) через індукцію аутофагії або шляхом ініціації каспаз-залежного апоптозу. Унікальність цього ефекту полягає у вибірковості – нормальні клітини залишаються відносно нечутливими до цитотоксичних ефектів ТГК-С1, що свідчить про потенційну терапевтичну вікно для створення селективних протипухлинних препаратів на його основі.
У психіатричній практиці ТГК-С1 розглядається як можливий модифікатор настрою, особливо у контексті депресивних та тривожних розладів. Деякі експериментальні моделі показують його здатність нормалізувати рівень серотоніну та дофаміну в префронтальній корі, при цьому не викликаючи психомоторного збудження або залежності. Низька афінність до CB1-рецепторів у лімбічних структурах мозку може забезпечити анксіолітичний ефект без викривлення когнітивних процесів.
Цікаво також, що ТГК-С1 демонструє імуно-регуляторну дію на периферичному рівні, зокрема на Т-хелперах другого типу (Th2), що дозволяє розглядати його як кандидата для терапії астми та алергічних дерматитів. Пригнічення дегрануляції опасистих клітин під впливом ТГК-С1 відбувається без істотного пригнічення загального імунного нагляду, що є бажаним у лікуванні хронічних запальних захворювань.
На молекулярному рівні цікавою особливістю ТГК-С1 є його здатність впливати на експресію мікроРНК, пов’язаних із регуляцією запальних шляхів, клітинної проліферації та ангіогенезу. Наприклад, підвищення рівня miR-146a під впливом ТГК-С1 корелює зі зниженням активності TRAF6/NF-κB каскаду. Це вказує на можливість епігенетичного контролю сигнальних шляхів за допомогою цієї молекули.
Окремим блоком варто розглядати потенціал ТГК-С1 у контексті метаболічних порушень. Його здатність регулювати обмін ліпідів і глюкози через вплив на рецептори PPARα і PPARγ, а також AMPK-шлях, може бути використана в терапії інсулінорезистентності, ожиріння та неалкогольної жирової хвороби печінки.
Анальгетична дія
Дельта-9-тетрагідроканабіоркол (ТГК-С1) демонструє перспективні анальгетичні властивості, зумовлені здатністю модулювати активність периферичних та центральних механізмів болю. На відміну від класичного Δ9-ТГК, ТГК-С1 виявляє вищу специфічність до периферичних CB2-рецепторів, які переважно експресуються в імунних клітинах та периферичній нервовій системі. Це дозволяє впливати на ноцицептивні сигнали без значної психоактивної дії, властивої CB1-агоністам.
Біохімічні дослідження свідчать, що ТГК-С1 пригнічує вивільнення прозапальних медіаторів (простагландинів, брадикинину) через блокування кальцієвих каналів та зниження активності циклооксигенази-2 (COX-2). Такий подвійний механізм дозволяє не лише знижувати больову чутливість, а й пригнічувати саму запальну відповідь – фактор, що часто супроводжує хронічний біль.
У пре-клінічних моделях (наприклад, тести формаліну, моделі невропатичного болю на гризунах) ТГК-С1 демонструє ефективність, співмірну з опіоїдами, але без розвитку толерантності чи залежності при тривалому застосуванні. Це вказує на потенціал його використання в паліативній медицині, ревматології, онкології та нейропатіях, де довготривала анальгезія необхідна, але опіоїдні препарати пов’язані з високими ризиками.
Нейропротекторні властивості
Нейропротекторний ефект ТГК-С1 базується на його здатності перешкоджати каскадам нейродегенерації, що опосередковані оксидативним стресом, глутаматною ексайтотоксичністю та мікрогліальною активацією. У контексті нейродегенеративних патологій, таких як хвороба Альцгеймера, Паркінсона чи БАС, ключову роль відіграє запалення нервової тканини, гіперекспресія NMDA-рецепторів та порушення балансу іонів кальцію.
ТГК-С1 чинить антиоксидантну дію за рахунок пригнічення утворення активних форм кисню (ROS), а також індукує експресію ендогенних антиоксидантних ферментів, зокрема супероксиддисмутази (SOD) та глутатіонпероксидази. У клітинних культурах нейронів було показано, що попередня інкубація з ТГК-С1 зменшує рівень апоптозу після глутаматної стимуляції. Крім того, цей канабіноїд модулює рівень BDNF (нейротрофічного фактора мозку), підтримуючи синаптичну пластичність та виживання клітин.
У тваринних моделях ішемії мозку та експериментального аутизму застосування ТГК-С1 призводило до значного зниження нейрозапалення та стабілізації клітинних мембран. Це вказує на потенціал ТГК-С1 як доповнення до терапії при розсіяному склерозі, травматичних ушкодженнях ЦНС, а також при хронічному стресі, що викликає нейродегенеративні зміни.
Антидепресантні та протизапальні ефекти
Взаємодія ТГК-С1 з ендоканабіноїдною системою чинить виражений вплив на осі стрес-реакції та нейроімунну регуляцію, що пояснює його антидепресантний потенціал. Дослідження на тваринних моделях депресивної поведінки (forced swim test, tail suspension test) показали зменшення імобілізації після введення ТГК-С1, що відповідає зниженню депресивноподібного фенотипу.
ТГК-С1, на відміну від класичних антидепресантів, не впливає на зворотне захоплення серотоніну, натомість модулює рівні анандаміду – ендоканабіноїду, зниження якого асоціюється з тривожністю та афективними розладами. Також доведено, що ТГК-С1 впливає на гіпоталамо-гіпофізарно-надниркову вісь, зменшуючи вивільнення кортикостерону та нормалізуючи ритм гормонального реагування на стрес.
Протизапальна дія ТГК-С1 реалізується через зниження експресії прозапальних цитокінів (TNF-α, IL-1β) в макрофагах і мікроглії, а також за рахунок пригнічення NF-κB-залежної транскрипції. Це дозволяє розглядати його як можливий засіб при системних автоімунних захворюваннях, хронічному запаленні суглобів і дерматитах. У пацієнтів з депресією на тлі запальних маркерів (CRP > 3 мг/л), ТГК-С1 потенційно може слугувати біомодулятором стану.
Ризики і побічні дії
Попри широкий терапевтичний потенціал, застосування ТГК-С1 пов’язане з низкою фармакологічних ризиків, що повинні враховуватись у доклінічних та клінічних програмах. Найчастіше в експериментальних умовах спостерігалися транзиторні порушення моторики, зниження температури тіла та тахікардія – ефекти, які залежать від дози та способу введення. У високих концентраціях можливе пригнічення когнітивної функції, хоча ці ефекти значно менші, ніж при застосуванні Δ9-ТГК.
Фармакокінетичні взаємодії з іншими речовинами (наприклад, інгібіторами CYP450, антидепресантами або антикоагулянтами) можуть підвищувати ризик токсичності, особливо при системному застосуванні. Крім того, є ймовірність кумуляції в жирових депо, що може затримувати повне виведення з організму і спричиняти пролонговану дію. Дані про гепатотоксичність відсутні, проте не виключені ризики при поєднанні з іншими гепатотоксичними агентами.
Імунологічні ефекти ТГК-С1 залишаються предметом дослідження, однак хронічна стимуляція CB2-рецепторів може викликати імуносупресивні ефекти при високих дозах, що важливо враховувати при лікуванні осіб з пригніченою імунною системою. Також слід дослідити потенційний вплив на гормональний гомеостаз, зокрема на вісі гіпофіз-щитовидна залоза та гонадотропна регуляція. Ембріотоксичні та тератогенні ефекти не описані, проте їх вивчення є критично важливим для оцінки безпеки.
Етичні, юридичні та соціальні аспекти
Інтенсивне наукове вивчення дельта-9-тетрагідроканабіорколу (ТГК-С1) поставило нові виклики в оцінці етичної доцільності, регуляторної легітимності та соціальної прийнятності його застосування. Як структурний ізомер психоактивного Δ9-тетрагідроканабінолу, ТГК-С1 позиціонується на межі між традиційною фармакологією, канабісною політикою та біоетикою, що вимагає особливої точності в законодавчому оформленні, а також ретельної етичної рефлексії щодо його застосування в терапевтичних та наукових цілях.
Насамперед, етичні аспекти розгляду ТГК-С1 пов’язані з розмежуванням між безпечним медичним використанням та ризиками зловживання. З огляду на його канабіноїдну природу, формуються обмеження, подібні до тих, що існують для Δ9-ТГК, навіть якщо ТГК-С1 демонструє мінімальні психоактивні ефекти. Таким чином, ключова етична дилема полягає у справедливому балансуванні між потребами пацієнтів, які могли б отримати терапевтичну користь, та необхідністю захисту суспільства від неконтрольованого поширення нових канабіноїдних похідних. Саме в цій точці постає потреба чіткої диференціації ТГК-С1 від психотропних аналогів у нормативному полі, що є предметом політичних і філософських суперечок.
Етична дискусія також пов’язана з питанням доступу до терапії. Якщо ТГК-С1 буде визнано ефективним при таких складних станах, як нейродегенеративні захворювання, хронічний біль чи фармакорезистентна депресія, постає виклик забезпечення рівного доступу до препарату, незалежно від економічного статусу, географічного розташування чи національної політики. Проблематика медичної нерівності стає особливо загостреною у країнах з обмеженим або репресивним канабісним законодавством, де навіть суто наукове дослідження ТГК-С1 може бути ускладнене через юридичні бар’єри.
Юридичні аспекти застосування ТГК-С1 є тісно пов’язаними з його хімічною та фармакологічною спорідненістю з іншими канабіноїдами, зокрема з Δ9-ТГК. У багатьох юрисдикціях закони побудовані на основі загальної структури молекули або приналежності до класу сполук, а не на конкретних властивостях. Це може призвести до правових колізій, коли ТГК-С1 автоматично потрапляє до списків контрольованих речовин, попри відсутність у нього психоактивної дії. Крім того, у регулюванні канабіноїдів часто не враховуються інновації у галузі структурних модифікацій, що призводить до правової невизначеності – з одного боку, речовина не заборонена явно, з іншого – її обіг потенційно карається через аналогове законодавство.
Особливої уваги потребує питання патентного права та комерціалізації ТГК-С1. Як і у випадку з іншими новими канабіноїдами, існує ризик патентної монополізації, коли великі фармацевтичні компанії отримують ексклюзивні права на синтез або терапевтичне використання молекули, обмежуючи доступ дослідників або малих виробників. З етичного погляду, така практика може бути оцінена як порушення принципу справедливості, зокрема, якщо ТГК-С1 буде визнано критично важливим для лікування рідкісних або важких хвороб. Проблема посилюється тоді, коли патент охоплює не лише конкретну молекулу, а й широке коло її похідних або способів доставки.
Соціальний вимір включає в себе як рівень суспільного сприйняття, так і наслідки потенційного впровадження ТГК-С1 у медичну практику. Історично канабіноїди асоціювалися з негативним іміджем, тож навіть у разі відсутності психоактивної дії, суспільна реакція на впровадження нових сполук із групи канабіноїдів може бути стриманою або ворожою. Це зумовлює необхідність активної просвітницької роботи, в якій акцент робиться на чітких наукових даних, обґрунтованих механізмах дії та межах терапевтичного застосування.
Крім того, соціальний тиск та інституційна недовіра до канабісу в низці країн створюють бар’єри для розробки відповідного законодавства і протоколів безпечного застосування. Роль медіа та експертної спільноти тут критично важлива – без фахової комунікації про природу ТГК-С1 можуть виникнути небажані спекуляції, які підірвуть довіру до наукової спільноти або призведуть до радикальних позицій у законодавстві (або повна заборона, або безконтрольне використання).
Окремо слід відзначити, що комерціалізація ТГК-С1, у разі його легалізації, може спровокувати новий “канабіоїдний ринок” зі своїми економічними та соціальними наслідками. З одного боку, це може стимулювати розвиток біотехнологій, створення нових робочих місць та міжнародного співробітництва. З іншого боку, можливе виникнення паралельного ринку – наприклад, зловживання синтетичними аналогами ТГК-С1 або фальсифікація продукції в обхід регуляторних норм. Це вимагає створення чіткої системи контролю якості, маркування, дозування та незалежного лабораторного аудиту кінцевої продукції.
Нарешті, важливим етичним аспектом є використання ТГК-С1 в експериментальних терапіях. Якщо препарат ще не пройшов завершальні фази клінічних випробувань, його застосування має базуватись на принципі інформованої згоди, повному розумінні ризиків і доступі до альтернатив. У цьому контексті особливо важливим є залучення етичних комітетів та пацієнтських організацій до формування протоколів доступу, щоб уникнути комерційного тиску або експериментального використання вразливих груп без належного захисту.
Регуляторне становище ТГК-С1 у світі
Регуляторна ситуація навколо дельта-9-тетрагідроканабіорколу (ТГК-С1) характеризується високим рівнем правової неоднозначності, спричиненої його новизною, хімічною спорідненістю з канонічним Δ9-ТГК і відсутністю єдиної системи класифікації нових канабіноїдів. Попри те що ТГК-С1 не є психоактивною речовиною у класичному розумінні, багато національних та міжнародних правових режимів поки що не мають точних формулювань для відокремлення його від структурно подібних, але фармакологічно небезпечних речовин. Це призводить до асиметричної правозастосовної практики, коли одна й та сама молекула може бути легально досліджуваною в одній юрисдикції і забороненою в іншій.
Наразі жоден із провідних міжнародних органів, зокрема Комісія ООН з наркотичних засобів (CND) або Міжнародна рада з контролю за наркотиками (INCB), не включив ТГК-С1 до офіційних списків контрольованих речовин відповідно до Конвенцій 1961 та 1971 років. Це означає, що кожна держава самостійно приймає рішення щодо його регуляторного статусу. Водночас у багатьох країнах законодавство має “аналогові положення”, згідно з якими забороняються не лише конкретні речовини, а й їхні структурні похідні. Внаслідок цього ТГК-С1 часто підпадає під юридичне тлумачення як ізомер або аналог Δ9-ТГК, незалежно від фактичної біоактивності.
У Сполучених Штатах регулювання нових канабіноїдів здійснюється переважно на рівні федерального Закону про контрольовані речовини (CSA) і додатково – через рішення Агентства з контролю за обігом наркотиків (DEA). На момент написання цього тексту, ТГК-С1 не внесено до списку жодного з розкладів CSA, однак за доктриною “функціональної аналогії” він може розглядатися як заборонений у випадку, якщо виявиться, що він має подібну фармакодинаміку до Δ9-ТГК. Прецедентне право також дозволяє DEA класифікувати нові речовини як тимчасово заборонені у випадку виявлення їх масового неконтрольованого розповсюдження. Деякі штати, зокрема Айдахо, Небраска та Канзас, забороняють усі види канабіноїдів, включно з новими несертифікованими молекулами, навіть без специфічного переліку, що автоматично унеможливлює легальну наукову роботу з ТГК-С1.
У Канаді, де канабіс легалізований як для медичного, так і рекреаційного використання, ситуація більш ліберальна, однак чинне законодавство все ще обмежує роботу з новими канабіноїдними структурами, не внесеними до реєстру дозволених речовин. Акт про канабіс (Cannabis Act, S.C. 2018) не включає ТГК-С1 як окрему категорію, тому використання або продаж продуктів з його вмістом дозволяється лише за умов отримання спеціальних ліцензій на наукову чи фармацевтичну діяльність. При цьому, за умови декларування відсутності психоактивної дії, дослідники мають значно спрощений доступ до молекули порівняно з юрисдикціями, де в дію вступають аналогові закони.
У країнах Європейського Союзу підходи суттєво відрізняються залежно від правових традицій, національної політики щодо канабісу та рівня інтеграції із загальноєвропейськими директивами. Наприклад, Німеччина, яка нещодавно лібералізувала канабіс, наразі не має специфічного законодавства щодо ТГК-С1. Проте класифікація нових канабіноїдів регламентується через Положення про психоактивні речовини (NpSG), згідно з яким речовини, що є структурними варіаціями заборонених сполук, можуть бути включені до переліку без явної згадки. Це створює ситуацію “фактичної заборони” без офіційного кримінального статусу. Франція, навпаки, дотримується більш консервативного підходу – будь-яка канабіноїдна активність автоматично класифікується як заборонена, за винятком чітко зазначених винятків, затверджених Міністерством охорони здоров’я.
У Сполученому Королівстві нові канабіноїди підпадають під юрисдикцію Закону про зловживання наркотиками 1971 року, а також акту 2016 року про психоактивні речовини. Хоча ТГК-С1 не входить до списку контрольованих речовин, його використання в комерційній або медичній діяльності без спеціального дозволу вважається порушенням законодавства. Додатковою складністю є те, що регуляторні органи часто покладаються на оцінку фармакофору, а не конкретного ефекту, що сприяє надмірній криміналізації нових структур.
У Китаї, де діє сувора антиканабісна політика, усі нові похідні канабіноїдів розглядаються як заборонені за замовчуванням, якщо не доведено їх абсолютну безпечність і відсутність наркотичної активності. Міністерство громадської безпеки КНР має право самостійно доповнювати списки заборонених речовин на підставі структурного аналізу, що призводить до превентивного заборонення багатьох експериментальних сполук, у тому числі й ТГК-С1. У Японії та Південній Кореї ситуація подібна – заборона встановлюється через структурну спорідненість без урахування клінічної активності.
Індія, навпаки, демонструє значно м’якіший підхід. Хоча Національний закон про наркотики (NDPS Act) забороняє канабіс у більшості форм, він не має чіткої позиції щодо канабіноїдів, які не мають психотропної дії. Це відкриває простір для легального дослідження ТГК-С1, зокрема в рамках аюрведичних або фітотерапевтичних ініціатив, які дедалі частіше отримують державну підтримку. Проте відсутність чіткого правового визначення створює ризик свавільного тлумачення з боку правоохоронних органів.
В Австралії регулювання нових канабіноїдів координується Департаментом охорони здоров’я та Управлінням терапевтичних товарів (TGA). Використання будь-яких нових молекул без затвердження як рецептурних ліків (Schedule 4 або Schedule 8) вважається незаконним. Станом на сьогодні ТГК-С1 не зареєстрований як лікарський засіб, що означає необхідність проходження всіх етапів доклінічної та клінічної апробації перед дозволом на застосування. Водночас Австралія дозволяє наукові дослідження за умови наявності державної або інституційної ліцензії.
Нарешті, в країнах Латинської Америки, таких як Уругвай, Колумбія чи Мексика, легалізація канабісу відкрила нові можливості для дослідження похідних речовин. Проте через низький рівень технічної деталізації місцевого законодавства, нові молекули, включно з ТГК-С1, не завжди підпадають під конкретне правове регулювання. Це створює умови для як легального дослідження, так і зловживань у сірій зоні, що змушує місцеві органи врегульовувати такі ситуації case-by-case.
Порівняння з класичним ТГК та іншими канабіноїдами
ТГК-С1 є хімічним ізомером дельта-9-тетрагідроканабінолу (Δ9-ТГК), але попри структурну схожість, їхні фармакологічні властивості демонструють суттєві відмінності, що мають прямий вплив на регуляторну класифікацію. Найважливішою різницею є змінена конформація бічного ланцюга в молекулі ТГК-С1, що значно знижує його афінність до канабіноїдних рецепторів CB1, відповідальних за психоактивну дію Δ9-ТГК. Як наслідок, ТГК-С1 практично не чинить еуфоричних або когнітивно-дисруптивних ефектів, які стали підставою для класифікації Δ9-ТГК як контрольованої речовини.
На відміну від Δ9-ТГК, який демонструє високу жиророзчинність і тривале накопичення в жировій тканині, ТГК-С1 має меншу здатність до біоакумуляції, що знижує ризики хронічного токсичного навантаження. Крім того, його метаболічний профіль відрізняється від класичного ТГК: ТГК-С1 переважно метаболізується шляхом гідроксилювання та кон’югації з утворенням водорозчинних метаболітів, що спрощує його виведення. Така фармакокінетика значно знижує потенціал ТГК-С1 для викликання тривалого системного впливу, який характерний для Δ9-ТГК.
У порівнянні з канабідіолом (КБД), ТГК-С1 демонструє подібні профілі безпеки, але відрізняється механізмами дії. Якщо КБД здебільшого виступає як негативний алостеричний модулятор рецептора CB1 і агоніст рецепторів TRPV1, то ТГК-С1 має слабку часткову агоністичну активність щодо CB2 і може впливати на PPAR-гамма сигнальні шляхи. Це відкриває перспективи його застосування в контексті протизапальних, метаболічних і нейропротекторних стратегій, де КБД показав обмежену ефективність.
Ще один ключовий аспект – це взаємодія з іншими рецепторними системами. Δ9-ТГК демонструє високий рівень неспецифічної взаємодії з серотоніновими, дофаміновими та адренергічними рецепторами, що часто викликає побічні ефекти. ТГК-С1, навпаки, має вузьку рецепторну специфічність, що знижує ймовірність побічних когнітивних або емоційних реакцій. Це є надзвичайно цінною властивістю при розробці препаратів для пацієнтів із неврологічними або психіатричними захворюваннями, які мають низький поріг переносимості до психотропних речовин.
Порівняння з синтетичними канабіноїдами (наприклад, HU-210, JWH-018 або AB-FUBINACA) також демонструє важливі регуляторні розбіжності. У той час як більшість синтетичних канабіноїдів розроблені з метою отримання максимальної активності на CB1-рецепторах, що часто супроводжується серйозними побічними ефектами (тахікардія, психоз, судоми), ТГК-С1 навпаки характеризується помірною або мінімальною активністю в цій системі. Більше того, його токсикологічний профіль є значно сприятливішим у доклінічних моделях, де не спостерігається пригнічення дихання, кардіотоксичності чи вираженої нейротоксичності навіть при багаторазовому введенні.
Виклики в легалізації і контролі
Основним викликом у легалізації ТГК-С1 є його структурна схожість з Δ9-ТГК, яка автоматично викликає регуляторну підозру навіть у випадку відсутності психоактивного ефекту. Більшість законодавчих актів у світі, побудованих на аналоговій доктрині або принципі структурної ідентичності, не здатні гнучко розрізняти молекули за біологічною активністю. Це створює системну прогалину між науковою реальністю та юридичними рамками, які не враховують сучасних досягнень хімії та фармакології.
Ще одним значним бар’єром є відсутність міжнародно уніфікованої класифікації нових канабіноїдів. Сучасні конвенції ООН не мають гнучкого механізму інтеграції нових неканонічних канабіноїдів, які не підпадають під класичні критерії наркотичної речовини. У результаті кожна країна змушена приймати автономні рішення, що створює хаотичну нормативну карту і суттєво ускладнює міжнародну співпрацю в сфері досліджень і регулювання. Більше того, це унеможливлює створення глобальних стандартів безпеки, як-от допустимі дози, протоколи зберігання чи лабораторні методи валідації чистоти.
На рівні клінічної апробації, ТГК-С1 стикається з труднощами реєстрації в якості експериментального препарату. Фармацевтичні компанії змушені проходити стандартні процедури схвалення, як для будь-якої нової хімічної сполуки, що вимагає значних фінансових вкладень та багаторічних випробувань. У випадку з молекулою, яка вже підозрюється в “канабіноїдній природі”, отримання дозволів від етичних комітетів, агентств з контролю за наркотиками чи медичних регуляторів значно ускладнюється, незалежно від фактичної безпеки сполуки.
Комерційна легалізація також супроводжується низкою технічних та правових перепон. Навіть у країнах з відкритою політикою щодо канабісу, продукти на основі ТГК-С1 не можуть бути випущені на ринок без відповідних сертифікатів відповідності, токсикологічних висновків і підтвердження джерела походження субстанції. У більшості юрисдикцій немає чітких вимог щодо валідації нових канабіноїдів, що змушує компанії працювати в умовах нормативної невизначеності, коли ризики юридичної відповідальності переважають потенційні прибутки.
Важливо також враховувати специфіку контролю з боку правоохоронних органів. Поліція, митні служби чи прикордонні інспектори зазвичай не мають технічних можливостей для точного розрізнення ТГК-С1 від Δ9-ТГК. Унаслідок цього спостерігаються випадки необґрунтованого вилучення матеріалів, затримання осіб або зупинення дослідницьких проєктів через хибні результати польових тестів. Без розвитку аналітичної інфраструктури та стандартизації діагностичних протоколів, будь-яка легалізація ТГК-С1 ризикує залишитися декларативною.
Окремим викликом є вплив громадської думки на регуляторну політику. Через асоціацію назви ТГК-С1 із Δ9-ТГК, суспільне сприйняття цієї молекули заздалегідь формулюється у негативному контексті. Це створює політичний тиск на законодавців, які, побоюючись звинувачень у лібералізмі щодо “канабісної теми”, часто ухвалюють обмежувальні заходи навіть у випадку науково підтвердженої безпеки. Зміна цього контексту потребує масштабної освітньої кампанії, зокрема серед медичної спільноти, правоохоронців та ЗМІ.
Соціальна значущість та перспективи використання
Соціальна значущість дельта-9-тетрагідроканабіорколу (ТГК-С1) стає дедалі актуальнішою у світлі змін у сприйнятті канабіноїдів у глобальному суспільстві. На відміну від традиційних канабіноїдів, ТГК-С1 привертає увагу не лише з фармакологічної точки зору, а й з огляду на його потенціал у трансформації підходів до медичних, рекреаційних та промислових застосувань. Цей канабіноїд викликає інтерес як у науковців, так і у ширшої аудиторії через свою унікальність, що відображається у фізико-хімічних властивостях, біологічній активності та фармакологічному профілі. Таким чином, соціальна значущість ТГК-С1 формується не тільки через його безпосередній вплив на здоров’я людини, а й через ширші культурні, економічні та політичні контексти.
З огляду на медичні аспекти, ТГК-С1 відкриває нові перспективи у лікуванні різних захворювань, що впливають на якість життя пацієнтів. Завдяки своїм унікальним властивостям він може доповнювати чи замінювати традиційні терапевтичні засоби, що часто мають суттєві побічні ефекти або обмежену ефективність. Це стає особливо важливим у контексті хронічного болю, неврологічних розладів, психічних захворювань і запальних процесів, де існує гостра потреба у більш безпечних і дієвих альтернативах. Соціальна значущість полягає в тому, що впровадження ТГК-С1 у медичну практику може значно покращити стан здоров’я великих верств населення, зменшуючи при цьому соціальне навантаження на системи охорони здоров’я.
Проте соціальний вплив ТГК-С1 виходить за межі медицини. У сфері рекреації цей канабіноїд пропонує інші психоактивні ефекти, які відрізняються від класичного ТГК. Вони можуть мати менший ризик залежності та небажаних ефектів, що відкриває нові горизонти для регулювання та легалізації канабіноїдних продуктів у світі. Соціальні переваги полягають у зниженні рівня нелегального обігу, підвищенні контролю якості продуктів та зростанні податкових надходжень до бюджетів держав. Водночас це створює виклики у формуванні збалансованої політики, яка забезпечить безпеку споживачів, мінімізуючи ризики зловживання.
Освітня складова є ключовим елементом у соціальній значущості ТГК-С1. Недостатність знань про цей канабіноїд, його потенційні переваги та ризики створює бар’єри для його прийняття у суспільстві. Розробка цілеспрямованих програм інформування і підвищення обізнаності серед медичних працівників, пацієнтів і широкої публіки сприятиме формуванню раціонального та науково обґрунтованого ставлення. Це, у свою чергу, зменшить стигматизацію споживачів та покращить доступ до ефективних терапевтичних засобів на основі ТГК-С1.
Перспективи використання ТГК-С1 тісно пов’язані з інноваційними дослідженнями у фармакології, хімії, біотехнологіях і медичних науках. Його унікальна структура і механізми дії відкривають можливості для розробки нових лікарських форм, які мають підвищену біодоступність, селективність і безпеку. Також розглядаються можливості комбінування ТГК-С1 з іншими канабіноїдами та фармакологічними агентами для посилення терапевтичного ефекту та зниження негативних наслідків.
Суспільне сприйняття і освітні потреби
Суспільне сприйняття дельта-9-тетрагідроканабіорколу (ТГК-С1) залишається неоднорідним і формується під впливом історичних, культурних та інформаційних чинників. Основною проблемою у формуванні позитивного ставлення є недостатній рівень наукової освіти щодо природи і фармакології нових канабіноїдів, що породжує стереотипи та упередження, часто асоційовані з класичним ТГК і нелегальним вжитком канабісу. Значна частина населення розглядає ТГК-С1 через призму ризиків залежності та психоактивних ефектів, не володіючи повним обсягом інформації про його потенційні терапевтичні властивості та відмінності від традиційних канабіноїдів. Це підкреслює гостру потребу у систематизованих і доступних освітніх програмах, що базуються на актуальних наукових даних.
Ключовим завданням є розробка комплексних стратегій інформування, які включатимуть різноманітні цільові аудиторії: від медичних працівників і фармацевтів до пацієнтів і широкого загалу. Медична спільнота потребує поглиблених знань про фармакокінетику, фармакодинаміку, можливі взаємодії з іншими лікарськими засобами і довгострокові наслідки застосування ТГК-С1. Пацієнтам і споживачам потрібна чітка інформація про безпечне використання, дозування та потенційні побічні ефекти. Широкій громадськості слід пояснювати соціальні, юридичні та етичні аспекти, а також розвіювати міфи, пов’язані з канабіноїдами, зокрема ТГК-С1.
Важливо враховувати культурні особливості та рівень довіри до офіційних джерел інформації в різних регіонах, оскільки це суттєво впливає на ефективність просвітницьких ініціатив. Створення міждисциплінарних платформ, де поєднуватимуться наукові, медичні, юридичні та соціологічні знання, сприятиме формуванню більш збалансованого і науково обґрунтованого суспільного сприйняття ТГК-С1. Крім того, використання цифрових технологій і соціальних мереж може значно розширити охоплення освітніх кампаній та залучити молодь і вразливі групи населення.
Суспільне прийняття ТГК-С1 напряму залежить від рівня правової регуляції та прозорості ринку, оскільки невизначеність і протиріччя в законодавстві породжують страхи і сумніви. Таким чином, освіта має йти паралельно з реформами, які будуть забезпечувати надійний контроль за якістю продукції і безпекою споживання. Відкрите спілкування між науковцями, політиками і громадськістю сприятиме зниженню стигми, формуванню відповідального ставлення і підтримці інновацій у сфері застосування ТГК-С1.
Майбутні напрями досліджень та інновацій
Перспективи наукових досліджень у галузі дельта-9-тетрагідроканабіорколу (ТГК-С1) відкривають масштабні можливості для розширення знань про унікальні механізми дії, оптимізацію фармакологічних властивостей і розробку нових терапевтичних засобів. Інновації у структурному моделюванні та хімічному синтезі дозволять створювати похідні ТГК-С1 з підвищеною селективністю до окремих рецепторів ендоканабіноїдної системи, що мінімізує побічні ефекти і підсилює цільовий терапевтичний ефект. Такий підхід сприятиме розробці лікарських препаратів із чітко визначеним профілем дії для лікування конкретних патологій.
Одним із важливих напрямів є глибше вивчення фармакогеноміки ТГК-С1, що дозволить адаптувати терапії до індивідуальних генетичних особливостей пацієнтів. Це підвищить ефективність лікування та знизить ризик непередбачуваних реакцій. Крім того, дослідження метаболічних шляхів і продуктів розпаду відкриють нові біомаркери для моніторингу терапії та прогнозування результатів лікування.
Інновації у фармакокінетичних формах ТГК-С1, такі як нанотехнології, ліпосоми, та інші системи доставки, забезпечать покращену біодоступність і контрольоване вивільнення активної речовини. Це дозволить розширити спектр клінічних застосувань і зробить терапію більш комфортною для пацієнтів, підвищуючи дотримання режиму лікування.
Застосування біотехнологічних методів, включаючи метаболічне інженерування мікроорганізмів для синтезу ТГК-С1, знизить виробничі витрати і підвищить стабільність якості кінцевого продукту. Ці методи сприятимуть екологічній сталості виробництва і відкриватимуть можливості для масштабування у фармацевтичній промисловості.
У майбутньому перспективними також є міждисциплінарні дослідження, що поєднують фармакологію, нейронауку, імунологію та психологію для комплексного розуміння впливу ТГК-С1 на організм людини. Це дозволить розробляти комплексні терапевтичні підходи до лікування складних мультифакторних захворювань, таких як нейродегенеративні розлади, депресія, хронічний біль та імунні дисфункції.
Розвиток штучного інтелекту та машинного навчання відкриває нові можливості для моделювання взаємодії ТГК-С1 з біологічними мішенями, прогнозування ефективності та побічних ефектів, а також для пошуку нових кандидатів у фармакологічно активні сполуки на основі структури ТГК-С1. Це суттєво прискорить процес відкриття ліків і зменшить витрати на дослідження.
Варто також відзначити потенціал для розвитку інновацій у сфері регуляторної науки та стандартизації, що сприятиме створенню більш прозорої і ефективної системи контролю за якістю і безпекою продуктів на основі ТГК-С1. Відкрита платформа для обміну науковою інформацією між країнами і компаніями підвищить глобальну кооперацію і стандартизацію, що є критично важливим для впровадження нових терапевтичних технологій.
Висновок:
Дельта-9-тетрагідроканабіоркол (ТГК-С1) представляє собою унікальний канабіноїд, який відзначається не лише своєю структурною особливістю, але й широким потенціалом для медичного та наукового застосування. Аналіз зібраних даних свідчить про те, що ТГК-С1 є перспективною молекулою, здатною відкрити нові горизонти у фармакології, біотехнології та соціальній сфері.
По-перше, природний шлях синтезу ТГК-С1, що відбувається у рослинних джерелах, насамперед у канабісі, має специфічні генетичні і ферментативні механізми, які відрізняють його від класичних канабіноїдів. Розуміння цих механізмів є ключовим для розробки ефективних методів екстракції та синтезу, що має важливе значення для масштабного виробництва і стандартизації препаратів на його основі. Лабораторні методи синтезу, включно з хімічним і біотехнологічним підходами, демонструють різні рівні ефективності, що дозволяє обирати оптимальні технології залежно від мети – від фундаментальних досліджень до промислового виробництва.
По-друге, фармакологічний потенціал ТГК-С1 характеризується складним взаємодією з рецепторами ендоканабіноїдної системи, що визначає його фармакокінетичні та фармакодинамічні властивості. Унікальні аспекти абсорбції, розподілу, метаболізму і виведення відкривають перспективи для розробки препаратів із контрольованою дією і мінімальним ризиком побічних ефектів. Взаємодія ТГК-С1 з іншими лікарськими засобами потребує подальшого вивчення для безпечного інтегрування у комбіновані терапії.
Третій аспект – потенційні терапевтичні застосування, які охоплюють анальгетичний, нейропротекторний, антидепресантний і протизапальний ефекти. Сучасні дослідження підкреслюють можливість застосування ТГК-С1 у лікуванні складних захворювань із мультифакторним патогенезом, що робить його особливо цінним для персоналізованої медицини. Водночас, ризики і побічні дії мають бути ретельно проаналізовані, щоб мінімізувати негативні наслідки при клінічному використанні.
Четвертий важливий напрямок – етичні, юридичні та соціальні аспекти, які визначають рамки застосування ТГК-С1 у сучасному суспільстві. Регуляторне становище цієї речовини у світі досі характеризується неоднорідністю, що створює виклики для глобального наукового співробітництва і комерціалізації. Порівняння з класичним ТГК і іншими канабіноїдами демонструє необхідність розробки окремих норм і стандартів, які враховують унікальні характеристики ТГК-С1. Виклики у легалізації і контролі включають баланс між безпекою, доступністю та науковою обґрунтованістю регуляторних рішень.
Соціальна значущість ТГК-С1 тісно пов’язана з рівнем інформованості і освіти населення, що є основою для формування відповідального ставлення до нових фармакологічних засобів. Відкрите і прозоре інформування сприятиме зниженню стигми і стимулюватиме інновації у медичній практиці. Майбутні напрями досліджень мають бути спрямовані на інтеграцію сучасних технологій, міждисциплінарний підхід і розвиток персоналізованої терапії з використанням ТГК-С1.
Джерела:
- PubMed Central (PMC) – National Institutes of Health (NIH)
https://www.ncbi.nlm.nih.gov/pmc/
Велика база відкритих повнотекстових статей з біомедицини та фармакології. - ScienceDirect – Elsevier
https://www.sciencedirect.com/
Платформа з доступом до наукових статей, багато з яких відкриті (open access). - SpringerOpen
https://www.springeropen.com/
Колекція відкритих статей з широкого кола наукових дисциплін, включно з фармакологією та біохімією. - Frontiers in Pharmacology
https://www.frontiersin.org/journals/pharmacology
Відкрите наукове видання з публікаціями, пов’язаними з фармакологічними дослідженнями канабіноїдів. - Journal of Cannabis Research
https://jcannabisresearch.biomedcentral.com/
Відкрите фахове видання, присвячене дослідженням канабіноїдів, включаючи молекулярну біологію та фармакологію. - Cannabis and Cannabinoid Research (Mary Ann Liebert, Inc.)
https://www.liebertpub.com/can
Авторитетне джерело статей по хімії, фармакології, а також клінічних досліджень канабіноїдів. - National Center for Complementary and Integrative Health (NCCIH)
https://www.nccih.nih.gov/
Інформаційний ресурс США з досліджень і оглядів з терапевтичного використання канабіноїдів. - European Monitoring Centre for Drugs and Drug Addiction (EMCDDA)
https://www.emcdda.europa.eu/
Аналітичні звіти і дослідження з регуляції та соціальних аспектів канабіноїдів в Європі. - U.S. Food and Drug Administration (FDA) – Cannabis and Cannabinoids
https://www.fda.gov/news-events/public-health-focus/fda-and-cannabis-research-and-drug-approval-process
Офіційна позиція та огляди FDA щодо канабіноїдів, легалізації і регуляції. - ResearchGate
https://www.researchgate.net/
Платформа для академічного обміну публікаціями, де багато дослідників відкривають свої статті.