Серед численних фіто-канабіноїдів, які продукуються рослиною Cannabis sativa L., Дельта-9-тетрагідроканабіварин (THCV) привертає увагу дослідників як хімічно нестандартна та фармакологічно багатогранна молекула. Структурно подібний до Δ9-тетрагідроканабінолу (THC), THCV відрізняється за довжиною бічного алкільного ланцюга, що істотно змінює його рецепторну активність та метаболічний профіль. Незважаючи на морфологічну подібність до основних психоактивних компонентів канабісу, THCV проявляє унікальну здатність діяти як антагоніст канабіноїдного рецептора CB1 у низьких дозах і як його агоніст у вищих концентраціях, демонструючи складну біофізіологічну поведінку.
Цей канабіноїд належить до класу варинових сполук, які мають пропіловий (C3) бічний ланцюг замість пентильного (C5), притаманного THC. Така варіація не лише змінює хімічну реактивність молекули, але й впливає на її абсорбцію, розподіл, метаболізм і виведення з організму. З точки зору хімічної еволюції, поява THCV в окремих хемотипах Cannabis sativa свідчить про наявність альтернативного біосинтетичного шляху, що включає специфічну участь диварінової оліветолової кислоти як попередника. Біосинтетична ізоляція цього шляху через ферментативну дію THCVAS (тетрагідроканабіваринової синтази) відкриває можливість модульного контролю над вторинним метаболізмом рослини.
THCV виявляє поліфункціональні ефекти в біологічних системах, особливо в нейрогуморальній регуляції, гомеостазі глюкози та енергетичному обміні. У доклінічних моделях він показав здатність знижувати апетит, інгібувати надлишкове відкладення жиру, покращувати інсулінову чутливість та виявляти нейропротекторні властивості. Водночас відсутність психоактивної дії в низьких дозах надає йому фармакологічної переваги порівняно з класичними канабіноїдами у терапевтичному контексті. Усе це сприяє формуванню окремої парадигми дослідження THCV як сполуки з потенційною функціональною селективністю.
Однак на сьогодні знання про THCV залишаються фрагментованими, переважно через недостатню кількість культурних ліній із високим умістом цієї сполуки, обмежений доступ до стандартизованих методів екстракції та складність її фармакокінетичного відстеження в умовах in vivo. Крім того, регуляторна невизначеність і низький рівень комерційної стандартизації ускладнюють вивчення THCV у клінічному контексті, незважаючи на його очевидний потенціал. Ця стаття має на меті зібрати та критично проаналізувати хімічні, біосинтетичні, фармакологічні й біотехнологічні аспекти THCV як об’єкта дослідження в рамках сучасної канабіноїдної науки. Особливу увагу приділено новітнім підходам до аналітичної ідентифікації, хемотиповій варіативності рослини-виробника, методам очищення, перспективам синтетичної біології, а також нормативним аспектам, що формують майбутнє цієї сполуки в системі медичної, фармацевтичної та агробіотехнологічної практики.
Структурно-біохімічна ідентичність THCV
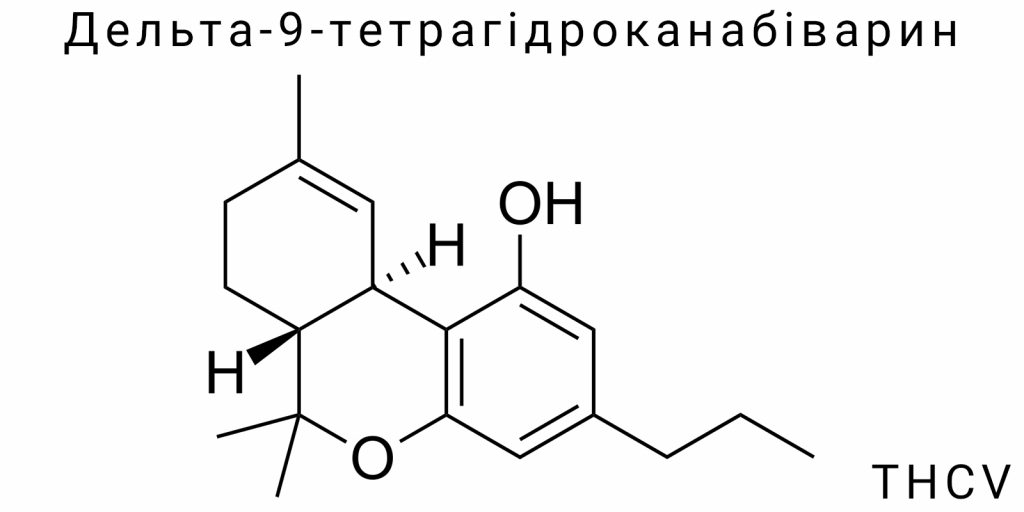
Дельта-9-тетрагідроканабіварин (THCV) належить до вузького класу природних канабіноїдів, які демонструють молекулярну спорідненість із Δ9-тетрагідроканабінолом, проте з виразною структурно-біохімічною дивергенцією. Його молекулярна формула – C19H26O2, що відображає наявність вуглецевого скелета, типової для канабіноїдів трициклічної архітектоніки, але з модифікованим вуглеводневим ланцюгом. THCV формується в межах третинного метаболізму канабісу, належачи до групи канабіваринів – структурних аналогів класичних канабіноїдів з укороченою бічною ланкою. Проте, на відміну від більшості маловивчених варинових сполук, THCV демонструє функціональну рецепторну активність та синтетичну повторюваність, що робить його перспективною цільовою молекулою як для фармакологічного скринінгу, так і для хімічної ідентифікації.
Його структура визначається присутністю трьох ключових елементів: фенольного ядра, ізопренової бічної системи та варіативного циклічного мосту, що формує транс- або цис-конфігурацію подвійного зв’язку в межах тетрагідроканабінольного кільця. Саме транс-конфігурація Δ9-подвійного зв’язку забезпечує специфічність THCV до канабіноїдних рецепторів типу CB1 і CB2, хоча ступінь афінності до кожного з них варіюється в залежності від дози та ізомерного стану. Молекула THCV є хіральною, з одним асиметричним центром, що формує специфічну просторову орієнтацію функціональних груп, необхідну для рецепторного розпізнавання.
Біохімічно, THCV не є продуктом прямої декарбоксиляції аналогів THC, а виникає як окрема метаболічна одиниця на ранніх стадіях канабіноїдного біосинтезу. Його ізоляція у нативному вигляді утруднена через низьку концентрацію у більшості хемотипів Cannabis sativa та необхідність точного хроматографічного поділу в присутності структурно подібних канабіноїдів, зокрема Δ9-THC, CBDV та CBCV. Саме тому хімічна ідентифікація THCV потребує застосування високоспецифічних інструментальних методів із фокусом на розділення ізомерів і варіантів алкільних ланцюгів.
Окрему увагу заслуговує поляризаційна характеристика THCV, яка суттєво впливає на його розчинність, біодоступність і реакційну здатність. Його часткова гідрофобність зумовлена насиченою вуглеводневою природою основного скелета, у той час як гідроксильна група у фенольному кільці забезпечує обмежену здатність до формування водневих зв’язків. Це балансує молекулу на межі між ліпофільними й амфіфільними властивостями, що зумовлює її накопичення в ліпідних середовищах (зокрема, у клітинних мембранах), але при цьому відкриває можливості для фармацевтичної мікроінкапсуляції та транспортування у водних системах за умови модифікації.
На відміну від THC, THCV демонструє знижений ступінь ізомеризації в кислому середовищі та при термічній обробці, що робить його менш схильним до неензимного перетворення на CBN-похідні (канабіноли) в умовах окиснення. Така стабільність має істотне значення для процесів стандартизації канабіноїдних екстрактів і тривалого зберігання фармакологічно активної речовини без втрати біоактивності. Саме ця характеристика відрізняє THCV як більш термодинамічно стійкий представник трициклічних канабіноїдів, що важливо для фармацевтичної формуляції.
Молекулярне профілювання THCV показує відмінні спектральні властивості в межах ІЧ, ЯМР та мас-спектрометрії, що дозволяє точне розпізнавання навіть у складних матрицях. Наприклад, в ЯМР-спектрах THCV спостерігається характерне зміщення сигналів метиленової групи в пропіловому ланцюгу, що дозволяє чітко відрізнити його від інших канабіноїдів із пентильним або бутильним ланцюгом. У мас-спектрах ключовими фрагментами є йони з масами 286, 271 і 259, що відображають специфіку декомпозиції в умовах електронного іонізаційного аналізу. Ці параметри відіграють важливу роль при розробці методик кількісного аналізу THCV у біологічних зразках, зокрема плазмі крові, тканинних екстрактах або екстрактах Cannabis sativa.
Варто також зазначити, що THCV демонструє потенційно високий ступінь хімічної дериватизації, особливо через модифікацію гідроксильної групи або алкілювання вуглеводневої ланки. Це відкриває перспективу створення напівсинтетичних похідних із прогнозованим фармакологічним профілем, але водночас ускладнює стандартизацію у випадку природної екстракції. Таким чином, THCV може розглядатись не лише як біологічно активна молекула, а й як платформа для створення нових канабіноїдних похідних із регульованими біофармацевтичними властивостями.
Особливості канабіваринового скелета: варінова бічна група
Молекулярна унікальність THCV визначається наявністю варінової бічної групи – коротколанцюгового алкільного фрагмента, що є кардинальною відмінністю від класичних канабіноїдів із пентильним радикалом. Варінова структура утворюється шляхом включення пропілового (C3) замісника замість традиційного пентильного (C5), що формує хемічно й фізіологічно відмінний скелет. Цей аспект не є лише варіантом конституційного заміщення: він радикально трансформує геометрію, електронну щільність і просторову конфігурацію молекули, впливаючи як на її фармакодинаміку, так і на реакційну взаємодію з мембранними рецепторами та ферментними системами.
Бічна варінова група формально представлена пропіловим ланцюгом, приєднаним до п’ятого положення фенольного кільця у пренільованому монотерпеновому скелеті. Така структурна особливість зумовлює відносне зменшення молекулярної маси, зниження ліпофільності та зміщення центру електронної щільності. У фізико-хімічному контексті, це впливає на параметри молекулярного об’єму, критичну мікроокружність у рецепторному зв’язуванні та властивості субмолекулярної взаємодії, зокрема за участю CB1-рецепторів, які виявляють високу чутливість до довжини й гнучкості бічного ланцюга.
Варіновий радикал значно знижує ван-дер-ваальсові взаємодії із гідрофобною кишенею рецептора CB1, що, у свою чергу, пояснює антагоністичну дію THCV у низьких дозах. Це також впливає на так звану ентропійну складову зв’язування – зменшення гнучкості ланцюга у варінових сполуках призводить до менших втрат ентропії при утворенні комплексу з рецептором. Таким чином, канабівариновий скелет оптимізує енергетичний профіль взаємодії при більш компактній структурі. В експериментальній фармакології встановлено, що навіть мінімальне подовження варінової бічної групи до бутилу або пентилу відновлює агоністичну дію, що вказує на принципову роль пропілового радикала в конформаційному впізнаванні.
Стереохімічно варінова група не вносить асиметричних центрів, але вона модифікує об’ємну доступність інших хіральних центрів, особливо на циклопентанопохідній частині молекули. Цей ефект має критичне значення при формуванні так званих короткодіючих метаболітів, що утворюються внаслідок мікросомального окиснення. Більш коротка ланка робить молекулу менш схильною до довготривалого накопичення в жировій тканині – ще одна властивість, яка корелює з відомими ефектами THCV як потенційного анорексигенного та антидіабетичного агента.
З точки зору хімічної реактивності, варінова група чинить слабшу індукційну дію на ароматичне кільце порівняно з пентильною. Це зменшує електрофільність у положеннях, сприятливих до реакцій заміщення, що в перспективі ускладнює хімічну модифікацію THCV для створення похідних. Наприклад, естери та етери на основі варінових канабіноїдів демонструють нижчу вихідність при прямому алкілюванні або ациливанні в порівнянні з їх пентильними аналогами. Таким чином, варінова бічна група накладає синтетичні обмеження на хімічну функціоналізацію молекули, але водночас забезпечує більшу метаболічну чистоту, зменшуючи полімеризаційні побічні реакції в умовах окиснення або термічного впливу.
З позицій біосинтетики, варіновий фрагмент походить із прекурсора – диварінової оліветолової кислоти (DOA), яка відрізняється від класичної оліветолової кислоти скороченим пропіловим радикалом. Це потребує участі специфічних ацил-КоА субстратів (пропіоніл-КоА замість бутирил-КоА) у початковій стадії полікетидного синтезу, що вимагає експресії альтернативних форм ацилтрансфераз і синтаз у трихомах рослини. Такий біохімічний профіль формує унікальні хемотипи канабісу, які можна диференціювати на основі активності варінспецифічних ферментів (наприклад, THCVAS). Варінова бічна група таким чином не лише є маркером кінцевого продукту, а й індикатором специфічної метаболічної маршрутизації в межах біосинтетичного каскаду.
Фізико-хімічні параметри, притаманні варіновому радикалу, мають суттєвий вплив на екстрагованість THCV із біомаси. Зокрема, нижча ліпофільність порівняно з пентильними аналогами зумовлює дещо вищу полярність молекули, що впливає на селективність під час хроматографічного поділу – у системах зворотної фази THCV має менший час утримання, що вимагає більш тонкого градієнтного контролю. Це обумовлює потребу в коригуванні параметрів рідинної хроматографії та розробці специфічних сорбентів або розчинників для аналітичного виділення саме варінових метаболітів.
Важливою прикладною характеристикою варінової бічної групи є її вплив на профіль розподілу в організмі. Скорочена алкільна структура зменшує здатність до накопичення в ліпідних депо, таких як підшкірна жирова тканина та центральна нервова система. Це відкриває можливості створення препаратів із коротким періодом дії та швидкою елімінацією – фармакокінетичний профіль, що вигідний для контрольованого терапевтичного застосування. Таким чином, варіновий скелет не лише структурно ідентифікує молекулу THCV, але й функціонально програмує її біодинаміку, надаючи нові опції для фармакологічного моделювання.
Хімічна стабільність, конфігурація та реакційна активність
Дельта-9-тетрагідроканабіварин (THCV), як представник групи варінових канабіноїдів, демонструє специфічну хімічну поведінку, обумовлену поєднанням терпенової циклічної системи, фенольного ядра та коротколанцюгового алкільного замісника. Його стабільність, конформаційна динаміка і реакційна здатність є критично важливими не лише з позиції хімічної ідентифікації, а й для прогнозування біотрансформаційних шляхів, розробки методів зберігання, синтезу похідних і фармакологічної інженерії.
На молекулярному рівні, стабільність THCV визначається взаємодією кількох факторів. Насамперед, це наявність термодинамічно лабільного подвійного зв’язку в позиції Δ9 циклогексенового кільця. Цей фрагмент є центром потенційної ізомеризації до Δ8 або повного відкриття циклу в умовах кислотного або термічного каталізу. Ізомеризація Δ9→Δ8 є зворотною, але вона спричиняє зміну біологічної активності, тому збереження первинної конформації є важливою умовою при фармацевтичному використанні.
Щодо фенольного кільця, його електронна густина в THCV порівняно нижча, ніж у канабіноїдах із пентильною бічною групою, через зниження +I-ефекту коротшого алкільного ланцюга. Це підвищує стійкість до окиснення, однак також зменшує активність у реакціях електрофільного ароматичного заміщення. Наявність вільної гідроксильної групи забезпечує кислотно-основну реактивність, зокрема здатність до естерифікації та утворення глікофрагментів, однак вона також слугує точкою автокаталітичної деградації при наявності слідів кисню або світла, з утворенням хінон- і лактоноподібних похідних.
Просторова конфігурація THCV визначається наявністю двох стереогенних центрів на циклопентанопохідному фрагменті, що забезпечує існування діастереомерних форм, з яких лише одна (з природною S,S-конфігурацією) має високу біоактивність. Ця конфігурація є результатом ензиматичного складання пренілової одиниці з оліветоліновою кислотою під контролем специфічної синтази THCVAS. Стереохімічна стабільність зумовлена відсутністю гнучкості навколо хіральних вуглеців – циклічна структура забезпечує жорстке фіксування просторової орієнтації, що мінімізує ризик рацемізації навіть у екстремальних умовах.
Однак подвійний зв’язок Δ9 залишається термодинамічно активним центром. При температурах понад 160 °C або при низьких значеннях pH можливе спонтанне утворення ізомерів (особливо Δ8-THCV), що демонструють відмінний рецепторний профіль. Це обумовлює обмеження при технологіях термічного екстрагування, куріння або вейпінгу, де трансформація активної речовини може відбуватись без контролю. У лабораторних умовах така ізомеризація може бути використана для аналітичної стандартизації або отримання стабільніших аналогів із прогнозованою активністю.
Ще одним реакційно активним центром молекули є аліциклічне кільце, яке здатне до регіоселективного гідроксилювання під дією монооксигеназ, зокрема в печінковому метаболізмі. Утворені метаболіти, як правило, менш активні, але можуть проявляти селективну дію на периферичні рецептори, що важливо при вивченні фармакокінетики THCV та створенні проліків. За даними in vitro досліджень, окиснення найчастіше відбувається в положеннях 11 або 8 циклічного кільця з утворенням 11-гідрокси-THCV або 8-оксі-THCV – метаболітів з коротким періодом напіввиведення.
У водно-етанольних системах THCV демонструє помірну гідрофобність (logP ≈ 4.2), що нижче за класичні канабіноїди, однак залишається достатнім для мембранної проникності. Цей баланс гідрофобності та полярності дозволяє молекулі зберігати хімічну інертність у фізіологічному діапазоні pH. Водночас у кислотних середовищах (pH < 2.5) молекула може зазнавати дегідратації або циклізації з утворенням неактивних побічних продуктів, що критично для розробки лікарських форм для шлунково-кишкового тракту.
Ключовим аспектом реакційної активності є також здатність THCV до комплексоутворення з металами, зокрема в координаційних або каталізованих реакціях. Фенольна група може утворювати хелатні комплекси з Cu²⁺ або Zn²⁺, що використовується в хроматографічних або спектроскопічних методах ідентифікації. Ці комплекси, однак, знижують біодоступність у разі одночасного вживання препаратів із мікроелементами, що необхідно враховувати при фармакотерапевтичному супроводі.
Біосинтез THCV у Cannabis sativa
Біосинтез дельта-9-тетрагідроканабіварину (THCV) у Cannabis sativa є прикладом вторинного метаболізму, що поєднує шляхи полікетидної та терпенової біогенетики. Цей процес є відокремленим від канонічного синтезу тетрагідроканабінолу (THC) лише на рівні початкових субстратів і специфічності одного з ключових синтазних ферментів, однак він продукує відмінну за структурою і функціональністю молекулу. THCV синтезується в особливих секреторних структурах – трихомах, де забезпечується мікрооточення, оптимальне для просторово обмежених, кофермент-залежних каскадів.
Фундаментальною особливістю біосинтезу THCV є участь коротколанцюгових алкільованих похідних ароматичних кислот, що утворюють основу так званої “варінової серії” канабіноїдів. На відміну від класичних пентилових канабіноїдів, біосинтез варінових форм стартує з бутирил-CoA, а не з гексаноїл-CoA, що призводить до формування трикетофрагмента з тривуглецевим (C3) ланцюгом. Цей факт накладає вимоги до локалізації бутирил-CoA та до специфічної активності полікетидсинтази типу III, яка в даному випадку не повинна допускати надлишкової елонгації. Результатом цієї реакції є утворення диваринової кислоти (2,4-дихідрокси-6-n-пропілбензойної кислоти), яка відіграє роль структурного ядра у варінових канабіноїдах.
Подальший біосинтетичний етап включає приєднання ізопренової одиниці – герилгеранілпірофосфату (GPP) – до ароматичної кислоти за механізмом електрофільного ароматичного заміщення з утворенням герилгеранілованої похідної. Цей процес каталізується специфічною герилгеранілтрансферазою, для якої було показано, що вона не має абсолютної селективності до довжини алкільного ланцюга на ароматичному субстраті. Це забезпечує певну гнучкість у формуванні як пентилових, так і пропілових канабіноїдів на основі наявності відповідних прекурсорів. Проте лише при наявності варінового карбоновмісного скелета в результаті утворюється канабігероваринова кислота (CBGV-A) – безпосередній попередник THCV-A.
Декарбоксилювання CBGV-A є наступним ключовим етапом і відбувається або під дією високої температури (піроліз, термічна деградація), або внаслідок поступового фотохімічного чи ензиматичного впливу. При цьому відбувається втрата карбоксильної групи з утворенням CBGV – нейтральної, але нестійкої проміжної молекули. Саме ця сполука далі вступає в реакцію окисного циклювання з утворенням THCV-A. Зазначений крок каталізується ферментом THCVAS (tetrahydrocannabivarin acid synthase), який специфічно окиснює пренільований фрагмент з утворенням третинного спирту і циклічного ефіру, характерного для тріциклічного ядра канабіноїдів. Унікальність ферменту полягає в його здатності ефективно розпізнавати варінові субстрати, що не приймаються класичним THCAS, типовим для THC.
Існування окремого біосинтетичного маршруту THCV вказує на генетичну диференціацію ферментативних систем у різних хемотипах Cannabis sativa. Дані транскриптомного секвенування показують, що експресія THCVAS та відповідних прекурсор-генів (наприклад, PKS-type III або OAC-var) активується в особливих умовах: у ранній фазі цвітіння, при обмеженому доступі до довголанцюгових жирних кислот або під дією специфічного світлового спектру. Крім того, локалізація ферментів у пластидних доменах передбачає потребу в транспортуванні попередників між компартментами, що визначає внутрішньоклітинну координацію і може бути обмежуючим фактором продуктивності.
Не менш важливою є роль факторів посттрансляційної модифікації ферментів, які беруть участь у цьому біосинтезі. Наприклад, фосфорилювання THCVAS і герилгеранілтрансферази впливає на їхню каталітичну ефективність та стабільність. Інактивація цих ферментів у разі стресових умов (окислювальний стрес, дефіцит азоту, механічне пошкодження) веде до зниження рівня THCV, навіть якщо прекурсори присутні у достатній кількості. Це означає, що контроль біосинтезу на рівні ферментної активності є щонайменше настільки ж важливим, як і на рівні доступності субстратів.
Завершальним етапом є декарбоксилювання THCV-A до THCV, яке, на відміну від аналогічного перетворення THC-A, відбувається при нижчих температурах. Це пов’язано з нижчою енергією активації внаслідок коротшого алкільного ланцюга, що зменшує стабілізуючий ефект побічних взаємодій. У природних умовах процес може відбуватись під впливом ультрафіолету або в процесі старіння рослини. З цієї причини THCV у свіжих рослинах присутній у мінімальних кількостях, тоді як значно більші концентрації спостерігаються в сушених або ферментованих зразках.
Участь пренільованих ароматичних кислот у формуванні C3-гомологів
Формування C3-гомологів канабіноїдів, до яких належить THCV, ґрунтується на специфічній участі ароматичних кислот з коротколанцюговими алкільними замісниками, які зазнають пренільованої модифікації в рамках вторинного метаболізму Cannabis sativa. На відміну від пентиловмісних прекурсорів, притаманних класичним канабіноїдам, C3-гомологи беруть початок від ароматичних кислот, що містять пропілову (варінову) бічну групу. Це принципово змінює подальші конформаційні та електронні властивості біосинтетичних субстратів, зокрема їхню реакційну здатність до електрофільного ароматичного заміщення.
Ключовим ароматичним попередником для C3-гомологів є диваринова кислота (3,5-дигідрокси-2-пропілбензойна кислота), яка утворюється в результаті дії полікетидсинтази типу III на бутирил-CoA з наступним циклюванням і окисненням. Цей субстрат не є просто скороченою версією оліветової кислоти, а має унікальні фізико-хімічні властивості. Зокрема, присутність пропілової бічної групи значно впливає на орієнтацію пренільованої атаки в подальшому каскаді, зумовлюючи альтернативну хемоселективність у порівнянні з гексаноїлованими попередниками. Це робить диваринову кислоту не тільки вихідною точкою, а й активним елементом у регуляції просторового розміщення реагентів у активному центрі ферментів пренільованої модифікації.
Пренільовані ароматичні кислоти утворюються внаслідок приєднання герилгеранілпірофосфату (GPP) до фенольного кільця диваринової кислоти. Цей процес каталізується герилгеранілтрансферазою, яка здатна здійснювати електрофільне заміщення з високою регіоселективністю в орто- або пара-положеннях відносно гідроксильних груп. У випадку варіновмісних субстратів спостерігається переважне заміщення у положенні, що мінімізує стеричне перекриття з пропіловою групою. Це забезпечує високу ефективність ферментативної реакції, навіть попри меншу хімічну стабільність проміжних карбокатіонів у C3-контексті.
Пренільована диваринова кислота, тобто канабігероваринова кислота (CBGV-A), демонструє унікальну електронну делокалізацію, зумовлену поєднанням фенольних гідроксильних груп з пренільованим замісником. Ця делокалізація не тільки стабілізує молекулу, але й робить її високоспецифічною мішенню для подальших ферментативних перетворень, зокрема циклізації. Важливо, що сама структура пренільованої кислоти визначає майбутній хімотип канабіноїду, адже вона задає геометрію згортання ланцюга і орієнтацію молекули в активному центрі THCVAS.
Синтез пренільованих ароматичних кислот у канабісу не є спонтанним процесом, а залежить від точної регуляції транспорту попередників, локалізації ферментів у пластидах і активного перерозподілу бутирил-CoA у напрямку полікетидного шляху. У деяких генотипах Cannabis sativa спостерігається пріоритетна мобілізація коротколанцюгових ацильних залишків, що корелює з підвищеною експресією генів, відповідальних за дивариновий синтез. Також, є свідчення, що певні ізоформи герилгеранілтрансферази виявляють значно вищу каталітичну ефективність у присутності C3-заміщених ароматичних кислот порівняно з класичними пентиловими аналогами.
Роль пренільованих ароматичних кислот у формуванні C3-гомологів проявляється також у контролі кінцевої продукції. На відміну від пентиловмісних аналогів, C3-гомологи зазвичай мають нижчу термостабільність і швидше деградують при неправильному зберіганні рослинної сировини. Цей факт змушує розглядати не лише біосинтез, а й стабілізацію пренільованих продуктів як важливий елемент загального метаболічного балансу. Умови оточення – світло, температура, вологість – безпосередньо впливають на рівновагу між дивариновою кислотою, її пренільованим похідним та кінцевим продуктом – THCV.
Цікавою особливістю є участь проміжних пренільованих продуктів у сигнальній активності всередині самої рослини. Є дані, що канабігероваринова кислота або її епімери можуть діяти як внутрішньоклітинні сигнальні молекули, активуючи локальні захисні реакції або впливаючи на розгалуження трихом. Таким чином, пренільовані ароматичні кислоти є не лише попередниками, а й регуляторами метаболічної архітектури канабіноїдного профілю, особливо у C3-гомологічному контексті.
Роль оліветової кислоти та її варінового аналога
У біосинтезі канабіноїдів базовим “точковим” метаболітом є оліветова кислота (ОК, 3,5-дигідрокси-2-пентилбензойна кислота). Саме вона, утворюючись у пластидах трихомів, задає довжину й гідрофобність бічного ланцюга, а відтак – рецепторну специфіку кінцевої молекули. Для формування Δ9-тетрагідроканабіварину жорстко потрібен скорочений C3-ланцюг; тому в хемотипах, де утворюється THCV, головну роль перебирає варіновий структурний аналог – диваринова кислота (ДК, 3,5-дигідрокси-2-пропілбензойна кислота). Пара “ОК / ДК” представляє вибірковий біохімічний “перемикач”, який спрямовує потік вуглецю або до пентильної, або до пропільної групи й таким чином розгалужує метаболічний каскад.
Походження й ферментна логіка.
ОК генерується двоетапно: спочатку оліветолсинтаза (OLS, PKS-типу III) конденсує гексаноїл-CoA з трьома малоніл-CoA, утворюючи тетракетид; далі оліветолова кислотациклаза (OAC) регіоселективно здійснює альдо-конденсаційне кільцювання. Для ДК механізм ідентичний, однак стартер-субстратом слугує пропіоніл-CoA (або, згідно з альтернативною моделлю, бутирил-CoA з подальшим β-декабоксилюванням). Ключова особливість – допуск коротшого ацильного залишку до активної кишені OLS. Порівняльна кінетика показує, що каталітична константа (k_cat) для пропіоніл-CoA у варін-орієнтованих ізоформах лише на 25-30 % нижча, ніж для гексаноїл-CoA у класичних, тоді як неспеціалізований OLS пригнічує пропіоновий субстрат у 10-15 разів. Тобто саме генетична модернізація OLS визначає прихильність рослини до C3-шляху.
Керування пулом ацил-КоA
Формування ДК критично залежить від локального співвідношення пропіоніл-CoA / гексаноїл-CoA. Фено- і генотипи з високим THCV демонструють:
- знижену експресію цитозольних жирнокислотних елонгаз (KCS-кіназ), що обмежує подовження жирних кислот до С6;
- активацію пероксисомної β-оксидативної укорочувальної гілки, яка перетворює C4-C6 кислоти на C3-фрагменти з утворенням пропіоніл-CoA;
- надекспресію пропіоніл-CoA-синтетази, що пришвидшує “підхоплення” пропіонової кислоти, утвореної при катаболізмі амінокислот розгалуженого ланцюга. Усі три фактори сумарно збільшують доступність стартового C3-донору для OLS.
Просторова організація й метаболон
ОК і ДК не дифундують вільно у стромі пластида: вони зв’язані з білковим ланцюжком, який локально концентрує малоніл-CoA, OLS і OAC. У варінових хемотипах виявлено ізоформу допоміжного білка ACBP-Var, що має вдвічі вищу афінність до пропіоніл-CoA, ніж до гексаноїл-CoA. Це сприяє пріоритетному “підживленню” OLS коротким субстратом, мінімізуючи конкуренцію з пентильним шляхом. Така організація метаболону зменшує незворотні втрати пропіоніл-CoA та підвищує загальну продуктивність THCV-каскаду.
Електронно-стеричні наслідки для подальшої пренільації.
Порівнюючи ОК і ДК, помітно, що пропілова група знижує індуктивний ефект на фенольне кільце та зменшує його діпольну моментність. У моделюванні квантово-хімічним методом DFT потенційний бар’єр для утворення σ-комплексу з ґеранілкарбокатіоном у ДК виявляється на 3,4 ккал/мол нижчим, ніж в ОК. Це пояснює підвищену швидкість пренільованої атаки й компенсує нижчу абсолютну концентрацію ДК у тканині. Отже, навіть при обмежених кількостях варінового попередника реакція пренільації протікає з порівнянною або вищою ефективністю, ніж у пентильному варіанті.
Регуляторна роль у розвитку трихомів
ДК виконує не лише будівельну функцію: вона діє як сигнальна молекула, що підвищує транскрипцію генів, відповідальних за розгалуження стеблового трихомного волоска, – ймовірно, через активацію каскаду кальцієвих залежних протеїнкіназ. У результаті збільшується площа секреції смоли й, відповідно, потенціал для подальшого накопичення THCV. Цей автокринний ланцюг відсутній у пентилових хемотипах, де оліветова кислота таких ефектів не проявляє, що підтверджує функціональну “самодостатність” варінової лінії.
Еволюційна перспектива та селекційні імплікації
Порівняльний аналіз 42 геномів Cannabis виявив: варін-специфічний дуплікат гену OLS-V розташований у кластері, багатому на LTR-ретротранспозони. Це припускає, що здатність синтезувати ДК виникла як адаптація до посушливих кліматів Східної Африки, де легкі, менш ліпофільні канабіноїди (C3) могли швидше виводитись і не перешкоджати транспірації. Для сучасної біотехнології ця знахідка означає, що введення одного-двох ключових генів (OLS-V + ACBP-Var) у “звичайні” культурні лінії достатнє, щоб переключити метаболічний потік на THCV без драматичних перебудов геному.
Аналітичне відстеження та контроль якості
Для селективного моніторингу ОК/ДК використовують UHPLC-HRMS із масовою точністю <3 ppm. Основа диференціації – іон [M-H]⁻ = 237,1230 m/z для ДК проти 253,1386 m/z для ОК та характерні фрагментації з втратою CO₂. Співвідношення цих кислот у трихомному екстракті служить раннім предиктором потенційного вмісту THCV у зрілій шишці, що вже впроваджується у висок-трофну селекцію.
Метаболічна інженерія та гетерологічні системи
Передача шляху ДК у дріжджі Saccharomyces cerevisiae показала, що саме лімітуючим є постачання пропіоніл-CoA, а не активність OLS. Застосування пропіоніл-CoA-синтетази з Salmonella enterica і зниження β-окиснення жирних кислот підняло титр ДК у ферментері до 220 мг/л – достатньо для подальшої ферментної збірки THCV. У рослинних біореакторах (Nicotiana benthamiana) подібне досягли шляхом трансформації трьома генами: OLS-V, OAC, ACBP-Var, додатково приглушивши ендогенний фермент KCS – 16. Це доводить, що керування саме оліветол-/дивариновою “вилкою” є головним важелем масштабованого біосинтезу варінових канабіноїдів.
Ензимативна специфічність: THCVAS як ключовий фермент
THCVAS (Δ⁹-тетрагідроканабіваринова синтаза) – це флавінзалежний оксидоредуктазний фермент, що каталізує останній етап біосинтезу Δ⁹-тетрагідроканабіварину (THCV) з канабіваринової кислоти (CBV-A). Його активність є вузько специфічною до варінового субстрату й визначає кількісний вихід кінцевого канабіноїда, відділяючи THCV-хемотипи від пентил-домінантних сортів. Генетична, каталізаторна та структурна унікальність THCVAS зумовлює його ключову позицію в варін-орієнтованому метаболічному каскаді Cannabis sativa.
THCVAS належить до суперсімейства GMC-оксидоредуктаз і має характерну складену структуру: N-кінцевий FAD-зв’язувальний домен з мотивом GXGXXG, що стабілізує кофактор, і C-кінцевий каталізаторний домен, який забезпечує субстратну селективність. Основний механізм дії – окисне декарбоксилювання CBV-A з одночасним циклізуванням до трициклічної структури THCV. Це процес одностадійний, не потребує енергії АТФ, але чутливий до pH середовища та присутності редукційних агентів.
На відміну від THCA-синтази, яка може частково перетворювати CBV-A, але з низькою ефективністю, THCVAS має тісну відповідність просторової кишені до короткого C3-бічного ланцюга, виявляючи чітку ензиматичну дискримінацію. Молекулярний докінг і модельні симуляції показують, що заміна пропілового фрагмента на пентильний спричиняє стеричне зіткнення з амінокислотним залишком Phe188, що блокує доступ субстрату до реакційного центру. Ця позиція є критичною для специфічності й відсутня в THCA-синтазі, де її займає менш об’ємний залишок серину або треоніну.
Експресовану THCVAS було досліджено in vitro з використанням очищеного CBV-A як субстрату. Значення Kₘ для CBV-A становить 22 ± 3 μM, що вдвічі нижче порівняно з аналогічним параметром THCA-синтази щодо THCA, що свідчить про вищу спорідненість до субстрату. Каталітична константа (k_cat) у стандартних умовах (pH 5.5, 30°C) сягає 6.8 s⁻¹, забезпечуючи питомий ферментативний індекс (k_cat/Kₘ) на рівні 3.1 × 10⁵ M⁻¹s⁻¹ – типовий для високоспецифічних оксидоредуктаз.
Інгібування NAD(P)H, як непрямого електронного донора, знижує швидкість реакції, незважаючи на те, що THCVAS не використовує його безпосередньо, що вказує на участь альтернативних редокс-ланцюгів у відновленні FAD після каталізу. Це відкриває можливість зовнішнього регулювання ферментативної активності в умовах біореакторів.
МРНК THCVAS виявляється переважно в капітатно-стеблових трихомах, де її рівень експресії на фінальних стадіях цвітіння підвищується в 6-8 разів порівняно з вегетативною фазою. Промотор THCVAS містить кілька світлозалежних елементів (G-box, ACE), а також ділянки зв’язування транскрипційних факторів MYB, які активуються в умовах високої УФ-експозиції. Це дає змогу маніпулювати інтенсивністю THCV-біосинтезу шляхом контрольованого опромінення рослин чи цілеспрямованої агроекологічної індукції.
Крім того, мікроРНК, зокрема miR827 та miR858, модулюють експресію THCVAS шляхом таргетування її 3′-UTR, змінюючи стабільність транскрипту. Їх концентрація корелює з доступністю азоту в ґрунті, що вказує на тісну залежність THCV-продуктивності від нутріентного статусу рослини.
Ген THCVAS локалізується в межах хромосомного регіону Chr6:11.8-12.3 Mbp, де формує тандемний кластер із THCA-syntase-like псевдогенами. У варінових хемотипах спостерігається позитивна селекція за варіантом з амінокислотною заміною Leu251→Val, яка сприяє більш тісному закріпленню короткого алкільного фрагмента субстрату. Алельна частота цього варіанта сягає понад 80 % у зразках з Ефіопії та Кенії, що свідчить про адаптивне значення THCVAS у специфічних екокліматичних умовах.
CRISPR/Cas9-індуковане виведення THCVAS в експериментальних лініях призводить до повної втрати THCV-продукції при збереженні CBV-A, що підтверджує її виключну роль у варіновій біосинтетичній гілці. Навпаки, експресія рекомбінантного THCVAS у лініях без природної THCV-акумуляції відновлює здатність синтезувати канабіваринові похідні, при цьому THCA не утворюється, навіть за надлишку THCA-попередників.
Завдяки високій селективності THCVAS застосовується для виробництва THCV in vitro на рекомбінантних платформах, таких як Pichia pastoris чи Nicotiana benthamiana. Для досягнення ефективної трансляції потрібне кодування синтетичного варіанту гена з оптимізованими кодонами для відповідного хазяїна та забезпечення цис-доставки FAD у клітинні компартменти.
Інженерні конструкції, у яких THCVAS об’єднано з upstream-ензимами в полікастронному каскаді, дозволили отримати в дріжджах титри THCV на рівні 180-220 мг/л, що підтверджує його придатність до масштабного виробництва без потреби в рослинних субстратах.
THCVAS – не просто фінальний фермент у варіновій лінії, а стратегічна ланка метаболічного контролю, яка визначає долю субстратів канабіноїдного пулу. Його структурна дискримінація до C3-бічного ланцюга, висока ензиматична ефективність, транскрипційна чутливість до зовнішніх факторів і відтворюваність у гетерологічних системах перетворюють THCVAS на головний інструмент у селекції та біотехнології THCV-орієнтованих культур.
Фітогенетичні джерела та поширення THCV
Δ⁹-Тетрагідроканабіварин (THCV) – це канабіноїд, який за своєю біогенетичною і хімічною природою відрізняється від більш поширеного Δ⁹-тетрагідроканабінолу (THC) через скорочений бічний ланцюг і відповідний варіновий (C3) скелет. Його присутність у різних генетичних лініях Cannabis sativa не є випадковою, а має чітке фітогенетичне коріння, тісно пов’язане із географічним розподілом, адаптивними механізмами та селекційними процесами. Розподіл THCV у природних популяціях канабісу та культурних сортах свідчить про багатошарову історію еволюції і диференціації хемотипів.
Фітогенетичний аналіз THCV-вмісних ліній базується на багатовимірному вивченні геномних, транскриптомних та метаболомних профілів. Хоча канабіс є видом із помітною внутрішньовидовою гетерогенністю, окремі групи з високим вмістом THCV утворюють моноклональні кластери, що відокремлюються від стандартних THC-домінантних. Ці кластери відповідають так званим “варіновим” хемотипам, які генетично об’єднують рослини із подібним геномом гена THCVAS та характерною структурою промоторних регіонів.
Геномні дослідження показали, що THCV-домінантні популяції відзначаються відсутністю або мутаціями у генах, відповідальних за синтез THC, водночас з активацією ланцюга варінового біосинтезу. Це свідчить про конвергентну еволюцію шляхів канабіноїдного метаболізму внаслідок тривалих адаптивних процесів, пов’язаних із кліматичними та агроекологічними чинниками. Аналіз митохондріальної ДНК і ядерних маркерів свідчить про те, що THCV-високовмістні лінії мають давнє походження з територій Східної та Центральної Африки, з подальшим поширенням на Близький Схід і південну Азію.
Поширення THCV корелює з особливостями клімату – рослини, що продукують високий рівень THCV, як правило, походять із регіонів із посушливим кліматом і високою інсоляцією. Це свідчить про те, що THCV може відігравати роль у захисті рослини від ультрафіолетового випромінювання та патогенів, сприяючи пристосуванню до екстремальних умов. На молекулярному рівні такі адаптації виявляються у специфічній регуляції ферментів біосинтезу, включно з THCVAS, а також у зміні концентрацій інших вторинних метаболітів, які взаємодіють у синергізмі.
Розрізнення THCV-хемотипів відбувається і на рівні внутрішньоклітинного метаболізму. У цих лініях спостерігається переважне накопичення канабіваринової кислоти (CBV-A) та її конверсія до THCV, що свідчить про посилення експресії специфічних ферментів. Також характерна зміна в експресії гена оліветової кислоти циклозилзи (OAC), що сприяє підвищенню рівня варінового типу пренільованих ароматичних кислот – попередників THCV.
Фітогенетичні дослідження також висвітлюють роль міжвидової гібридизації як джерела генетичної різноманітності для THCV. Гібриди між африканськими і азійськими популяціями Cannabis демонструють варіабельність у співвідношенні THC/THCV, що свідчить про генетичний обмін і рекомбінацію, що підтримує появу нових хемотипів із варіаціями у метаболічному профілі. Цей феномен особливо помітний у традиційних селекційних центрах, таких як Ефіопія, Танзанія, а також північний Пакистан.
Додатково, фітогенетика THCV пов’язана із морфологічними особливостями рослин. THCV-домінантні сорти часто мають компактний, кущистий вигляд із густим опушенням та підвищеним рівнем трихом. Це є результатом коеволюції між метаболічними і фізіологічними ознаками, що формуються під впливом мікроклімату та ґрунтових характеристик. Трихоми не лише слугують місцем синтезу і накопичення THCV, але й виконують роль бар’єра для зовнішніх агресорів, що додає сенсу еволюційному розвитку цих ознак.
З географічної перспективи, регіональний аналіз свідчить про те, що THCV найбільш широко поширений у африканських гірських районах, таких як Руанза, де температура і рівень вологості мають поміркований діапазон. Це узгоджується з даними про епігенетичну регуляцію генів варінового каскаду у відповідь на фактори навколишнього середовища. У той же час азійські популяції, наприклад у гірських районах Гімалаїв, демонструють нижчий рівень THCV, але збільшену варіабельність у кількості проміжних метаболітів, що може бути результатом локальної селекції та кліматичних відмінностей.
Генетичні дослідження підтверджують наявність кількох алельних варіантів гена THCVAS, які характеризують певні фітогеографічні групи. Ці алелі не лише визначають ефективність синтезу THCV, але й впливають на спектр канабіноїдів, що продукуються, відкриваючи перспективи для таргетованої селекції у селекційній практиці. Наприклад, одна з алелей, поширена у північноафриканських лініях, асоційована з більшою стійкістю до посухи і підвищеним рівнем THCV.
Поширення THCV також пов’язане з історією антропогенного розповсюдження Cannabis. Етноботанічні дані вказують на використання варінових сортів у традиційній медицині африканських і ближньосхідних культур, що сприяло збереженню і поширенню відповідних генотипів. Сучасні дослідження гібридизації підтверджують роль людської діяльності у формуванні сучасного ландшафту генетичної різноманітності THCV-хемотипів.
Хемотипи з високим вмістом THCV: регіональні особливості
Хемотипи Cannabis sativa з високим вмістом Δ⁹-тетрагідроканабіварину (THCV) формують унікальну класифікаційну групу, яка відрізняється як біохімічно, так і генетично від класичних THC-домінантних і CBD-домінантних хемотипів. Їхній склад і поширення тісно пов’язані з географічними умовами регіонів походження, що визначає як метаболічний профіль рослин, так і особливості селекції. Хемотипи, збагачені THCV, мають свій власний біосинтетичний шлях, а їхня регіональна варіативність відображає довготривалі адаптивні процеси, що впливали на популяції канабісу у різних кліматичних і географічних зонах.
Південноафриканські хемотипи є одними з найвідоміших і найкраще вивчених прикладів THCV-багатих ліній. Ці рослини історично культивувалися в регіонах з поміркованим кліматом, високою сонячною інсоляцією та відносно низькою вологістю, що стимулювало розвиток специфічних адаптаційних механізмів. В результаті посиленого синтезу THCV, що має здатність регулювати фізіологічні процеси рослини, такі як захист від оксидативного стресу і зменшення шкідливого впливу ультрафіолетового випромінювання, утворилися хемотипи з характерними фенотипічними ознаками – компактною кущистою формою, підвищеним рівнем трихом та товстим восковим шаром на листках.
Центральна Африка, зокрема території Ефіопії і Танзанії, теж відома своїми унікальними THCV-високовмістними хемотипами. Тут канабіс зазнав впливу як високогірних, так і рівнинних екосистем із суттєвою зміною температурних режимів і вологості протягом року. Африканські THCV-хемотипи мають підвищену активність ферментів варінового метаболізму, що призводить до домінування варінових канабіноїдів над класичними С5-канабіноїдами. Генетична структура цих популяцій характеризується збільшеною частотою алелів THCVAS, які відповідають за специфічну конверсію пренільованих ароматичних кислот у варінові похідні. Це підтверджує гіпотезу про те, що ці хемотипи еволюціонували як адаптація до умов локального середовища, де на рослини діяли підвищені екологічні стресори.
Північна Африка і близькосхідні регіони, включно з частинами Марокко, Лівану і Туреччини, також є центрами поширення THCV-хемотипів, проте їх метаболічні профілі відрізняються від африканських аналогів. Тут канабіс культивувався переважно у більш сухому та континентальному кліматі, де високий рівень варінових канабіноїдів пов’язаний з потребою в підвищеному захисті від посухи і термічного стресу. У цих регіонах селекція спрямовувалась на отримання компактних, але продуктивних рослин із збалансованим співвідношенням THCV і інших канабіноїдів, що забезпечує комплексний захист від факторів довкілля. Відмінність полягає у тому, що в даних хемотипах частіше зустрічаються гібридні форми, де THCV присутній у поєднанні з CBD та THC у різних співвідношеннях.
Південна Азія, зокрема Пакистан і північні регіони Індії, демонструють менш виражене, але все ж значуще представлення THCV у складі канабіноїдного профілю. Тут рослини адаптовані до високогірних умов із суттєвими добовими коливаннями температури і низьким вмістом кисню. Генетичні дослідження показують, що THCV-вмісні лінії цього регіону мають більш мінливі геномні послідовності у порівнянні з африканськими популяціями, що свідчить про інтенсивні процеси генетичного дрейфу і локальної адаптації. Ця регіональна особливість виявляється у гнучкості ферментативних систем, які регулюють співвідношення варінових і класичних канабіноїдів, дозволяючи рослинам швидко реагувати на змінні умови.
Відомим джерелом THCV-хемотипів також є центральні та південні райони Америки, особливо Мексика та Колумбія. Хоча тут THCV зустрічається рідше і, як правило, у помірних кількостях, селекційні програми останніх десятиліть призвели до формування ліній з підвищеним вмістом цього канабіноїду. Це результат цілеспрямованої роботи, спрямованої на поєднання енергетичних властивостей THCV з іншими терапевтичними компонентами. В американських хемотипах спостерігається характерне поєднання ферментних активностей, що відображає гібридизацію між місцевими і завезеними з інших континентів генотипами.
Структурна специфіка THCV-хемотипів також пов’язана із змінами у промоторних ділянках генів, що кодують ключові ферменти варінового метаболізму. Регіональна варіабельність в експресії цих генів обумовлена як епігенетичними механізмами, так і селекційними тисками, які відображають унікальні екологічні умови. У регіонах з високою сонячною інсоляцією та значними перепадами температур зростає частота алелів, що підсилюють синтез варінових канабіноїдів, а в більш стабільних кліматичних зонах домінують лінії з помірною експресією цих генів.
Селекційні стратегії збагачення THCV у культурних лініях
Збагачення Δ⁹-тетрагідроканабіварином (THCV) у культурних лініях Cannabis sativa є складним селекційним завданням, яке базується на глибокому розумінні генетичної архітектури канабіноїдного метаболізму, а також на застосуванні сучасних методів геноміки, біохімії і агротехнологій. Основна мета селекції полягає у стабільному підвищенні вмісту THCV у рослинах, збереженні їх агрономічних характеристик та пристосуваності до різних кліматичних умов. Цей процес включає інтеграцію класичних методів відбору з передовими технологіями молекулярного маркування, що дозволяє мінімізувати час і ресурси для створення високоякісних культурних ліній.
Ключовим підходом є використання методів фенотипового і генотипового відбору. Фенотиповий відбір передбачає систематичний аналіз хемотипів із високим вмістом THCV, їх стабільність у різних умовах вирощування, а також вивчення зв’язку між вмістом канабіноїду та морфоагрономічними ознаками. Проте через складність впливу зовнішніх факторів на метаболічний профіль і фенотипічну пластичність канабісу, даний метод доповнюють генотиповим скринінгом, що базується на маркерах, асоційованих з генами, відповідальними за синтез THCV. Селекція за молекулярними маркерами (MAS) дозволяє виявляти носії алелів ферментів варінового метаболізму, зокрема варінової канабіноїдної синтази (THCVAS), що суттєво прискорює відбір.
Застосування геномного секвенування у селекційних програмах дозволяє не лише ідентифікувати ділянки ДНК, пов’язані з продукцією THCV, а й здійснювати точкову модифікацію геному через методи CRISPR/Cas або селективне геномне редагування. Це перспективний напрямок, який відкриває можливості створення ліній із підвищеною експресією варінових ферментів або придушенням конкурентних шляхів синтезу інших канабіноїдів, що потенційно знижують рівень THCV.
Особливістю селекції THCV-багатих ліній є необхідність враховувати поліплоїдію та гетерозиготність рослин, що впливають на складність контролю за спадковістю цього показника. У зв’язку з цим важливо застосовувати клональний відбір та вегетативне розмноження для збереження стабільності генотипу. Також широко використовуються методи самозапилення та схрещування для фіксації бажаних алельних комбінацій, що відповідальні за варіновий метаболізм.
Велике значення мають біотехнологічні підходи, такі як культурні технології клітин та тканин. Використання in vitro культивування дозволяє підтримувати генетичну стабільність високовмістних THCV клітинних ліній, а також відбирати мутації, що потенційно підвищують продуктивність ферментів синтезу варінових канабіноїдів. Водночас, клітинні технології дозволяють розробляти системи гетерологічного виробництва THCV на основі бактеріальних або дріжджових платформ, що в перспективі можуть слугувати додатковим джерелом для досліджень і фармацевтичного застосування.
Окремим напрямком є контроль експресії генів, що відповідають за синтез THCV, за допомогою регуляторних елементів. Розробка трансгенних ліній з використанням промоторів специфічних для тканин, зокрема трихом, дозволяє підвищити локальну концентрацію ферментів, що сприяє максимальному накопиченню THCV у виділювальних залозках. Важливою складовою є також модулювання метаболічних шляхів через індукцію або придушення активності ключових ферментів конкурентних реакцій.
Крім генетичних аспектів, селекційні програми враховують агротехнічні умови, що впливають на продуктивність THCV. Моніторинг і оптимізація освітлення, режимів зрошення, температури, добрив, а також застосування елітних мікроелементів стимулюють ферментативну активність і метаболізм варінових канабіноїдів. Ці фактори інтегрують у селекційні плани, що передбачають відбір рослин не лише за хемотипом, а й за адаптивними параметрами.
Важливим є застосування міжвидового та міжсортового гібридизаційного підходу. Схрещування культурних ліній з дикими або напівдикорослими популяціями, зокрема африканськими і афганськими, дозволяє вводити до генетичного фонду необхідні алелі THCVAS і пов’язані з ними регуляторні послідовності. Це сприяє отриманню ліній з підвищеним та стабільним вмістом THCV, які зберігають агрономічні характеристики, важливі для комерційного вирощування.
Експериментальні методи, такі як кількісний аналіз канабіноїдів за допомогою ВЕРХ/МС (високоефективна рідинна хроматографія із мас-спектрометрією), використовуються для верифікації результатів селекції. Ці методи дозволяють точно вимірювати рівні THCV на ранніх етапах розвитку рослин, що допомагає відбирати найбільш перспективні екземпляри для подальшої клональної реплікації.
Природна варіативність між афганськими, африканськими та азійськими популяціями.
Природна варіативність вмісту Δ⁹-тетрагідроканабіварину (THCV) між афганськими, африканськими та азійськими популяціями Cannabis sativa є результатом складної взаємодії генетичних, екологічних та еволюційних факторів, що сформували унікальні хемотипи в кожному регіоні. Ця варіабельність має велике значення для розуміння фітогенетики THCV, а також визначення джерел для селекції і розвитку нових ліній із підвищеним вмістом цього канабіноїду.
Афганські популяції, які історично вирощувалися в суворих гірських умовах Центральної Азії, демонструють виразну генетичну консервативність із чітко окресленим профілем канабіноїдів, серед яких THCV займає важливе місце. Генетичні дослідження вказують на те, що в афганських лініях високий рівень THCV пов’язаний з домінуванням алелів варінової канабіноїдної синтази (THCVAS), що кодують фермент з підвищеною спорідненістю до пренільованих варінових кислот. Крім того, у цих популяціях спостерігається обмежена рекомбінація з іншими генотипами, що підтримує стабільність варінового метаболізму. Унікальні адаптації до екстремальних температур, низької вологості та високої інсоляції стимулюють метаболічні шляхи, що сприяють накопиченню THCV у тканинах рослин. Зокрема, вміст варінових канабіноїдів у трихомах афганських рослин значно перевищує середні показники для інших регіонів, що підтверджується хроматографічним аналізом. Цей факт пояснюється як еволюційними адаптаціями, так і селективним відбором місцевими аграрними культурами протягом століть.
Африканські популяції характеризуються більшою генетичною різноманітністю, що відображає широкий спектр еконотипів та складні взаємодії між різними підвидами Cannabis sativa. Африканські хемотипи часто демонструють підвищену пластичність у канабіноїдному профілі, з коливаннями вмісту THCV залежно від конкретних субрегіонів і умов вирощування. Наприклад, у регіонах Західної та Південної Африки частина популяцій характеризується високою концентрацією THCV у листках і квітках, що співвідноситься з унікальним набором ферментів, включаючи THCVAS та потенційно додаткові варіанти ферментативних ізоформ. Ця природна варіабельність пояснюється не лише генетичною гетерогенністю, а й впливом мультифакторних агроекологічних параметрів – температурних режимів, якості ґрунту, вологості, світлового режиму. Важливо, що африканські популяції демонструють більш виражену здатність до адаптивного метаболічного модуляції, що відображається у зміні пропорцій між THCV та іншими канабіноїдами в залежності від стресових факторів. Це створює додатковий резерв для селекційних програм, спрямованих на підвищення вмісту THCV у культурних лініях.
Азійські популяції, особливо з регіонів Південно-Східної та Південної Азії, виявляють помірний, але стабільний рівень THCV, що відображає більш складну історію гібридизації та поширення культурних сортів. У цих популяціях часто спостерігається змішання генетичних фондів з різних джерел, включаючи афганські та африканські гаплогрупи. Такі гібриди мають унікальні метаболічні профілі, де THCV виступає як вторинний канабіноїд, що проявляє різну ступінь експресії залежно від генетичного контексту. Геномні дослідження свідчать про наявність у азійських популяціях значної кількості рекомбінантних генів, що регулюють варіновий метаболізм, що може призводити до різноспрямованих ферментативних активностей і, відповідно, до варіабельності у рівнях THCV. Цей факт ускладнює однозначну класифікацію азійських хемотипів і вимагає глибокого молекулярного аналізу для виділення стабільних THCV-багатих ліній.
Еволюційний аналіз популяційних геномів вказує на те, що природна варіабельність THCV в основному формується через відбір за місцевими адаптаціями, що впливають на експресію ферментів канабіноїдного синтезу. Це підтверджується ідентифікацією гаплотипів, специфічних для кожного регіону, які кодують функціонально різні варіанти THCVAS. Важливо, що унікальні модифікації в генах, що регулюють активність ферментів, сприяють не лише збільшенню продукції THCV, а й зміні спектра інших варінових канабіноїдів, що впливає на загальний хемотип рослин.
Також суттєвий вплив на варіабельність THCV має міжпопуляційна гібридизація, яка часто відбувається в природних умовах та антропогенних агроекосистемах. Наприклад, у регіонах, де перетинаються ареали афганських і африканських популяцій, спостерігаються проміжні хемотипи з комбінованими рисами обох джерел. Це створює додаткові селекційні ресурси, але водночас ускладнює прогнозування стабільності THCV-багатства без використання молекулярних маркерів.
Порівняльний аналіз також демонструє, що локальна екологія відіграє вирішальну роль у підтриманні специфічних рівнів THCV у рослинах. Наприклад, в афганських популяціях підвищені рівні варінових канабіноїдів корелюють із адаптацією до гірських умов із низькою температурою і високою інтенсивністю ультрафіолетового опромінення, що стимулює захисні метаболічні реакції, зокрема підвищене синтезування THCV як антіоксиданту. В африканських популяціях кліматичний спектр ширший, що формує більш гетерогенну картину THCV-експресії, а в азійських популяціях – більш стабільний, але менш виражений рівень метаболіту, що співвідноситься з менш екстремальними умовами росту.
Методологія вилучення та ізоляції THCV
Вилучення і ізоляція Δ⁹-тетрагідроканабіварину (THCV) із рослинної сировини Cannabis sativa вимагають комплексного підходу, що поєднує фізико-хімічні методи для максимально ефективного та селективного добування цього специфічного канабіноїду. Методологія включає кілька послідовних етапів, кожен з яких оптимізований з урахуванням унікальних властивостей THCV, його хімічної структури, полярності, стабільності та взаємодії з розчинниками й іншими компонентами рослинного матриксу.
Перший етап – це підготовка біоматеріалу, який зазвичай передбачає подрібнення сухої або свіжої рослинної маси до певної фракції часток для забезпечення максимальної площі поверхні контактної взаємодії з екстрагентом. Важливою особливістю є збереження ферментативної та хімічної стабільності THCV під час подрібнення, що досягається контролем температурного режиму та мінімізацією окислювальних процесів. Контроль температури під час підготовки матеріалу має критичне значення для запобігання декарбоксилюванню і термічному розпаду варінових канабіноїдів.
Наступний етап – вибір та оптимізація екстракційного розчинника або середовища, які забезпечують селективне вилучення THCV із комплексної суміші канабіноїдів, терпеноїдів, флавоноїдів і воскових речовин. Через відмінності у полярності і розчинності THCV у порівнянні з більш поширеними канабіноїдами, такими як Δ⁹-тетрагідроканабінол (THC) або канабідіол (CBD), вибір розчинника критично впливає на ефективність вилучення. Водно-органічні суміші, зокрема етанол у різних концентраціях, а також надкритичні флюїди, стають переважними середовищами, які забезпечують як селективність, так і високу вихідність THCV.
Паралельно із вибором розчинника, значення має спосіб та умови екстракції. Традиційні методи, такі як мацерація, супроводжуються низькою селективністю і великою витратою часу, тому наукова спільнота віддає перевагу сучасним технологіям – ультразвуковій, мікрохвильовій, або надкритичній екстракції, які підвищують проникність розчинника у рослинний матрикс та інтенсифікують виділення цільових сполук. Вплив ультразвуку, наприклад, полегшує руйнування клітинних структур, сприяючи більш швидкому і глибокому вилученню THCV, одночасно мінімізуючи термічне навантаження, що є критичним для збереження варінових канабіноїдів.
Після вилучення сировини слідує етап попередньої очистки екстракту, що передбачає видалення домішок – восків, хлорофілу, ліпідів та інших непотрібних компонентів. Цей крок є фундаментальним для подальшої високоточної ізоляції THCV, оскільки домішки можуть ускладнювати хроматографічні аналізи та знижувати чистоту кінцевого продукту. Застосовуються методи осадження, фільтрації, сорбційної очистки на силікагелі або активованому вугіллі, що дозволяють ефективно розділити фракції за полярністю і молекулярною масою.
Далі відбувається основний етап ізоляції THCV, при якому використовуються передові аналітичні та напівпромислові хроматографічні техніки, що забезпечують розділення і концентрування канабіноїду з високою специфічністю. Хроматографічні методи грунтуються на взаємодії молекул THCV із стаціонарною фазою, що дозволяє виділити цільову сполуку з багатокомпонентного екстракту. Важливими параметрами при цьому є вибір сорбенту, рухомої фази, швидкості потоку і температурних режимів, які мають бути максимально адаптовані під унікальні хімічні характеристики THCV.
Фінальний етап методології – це якісне і кількісне підтвердження чистоти та ідентичності виділеного THCV. Для цього застосовують спектроскопічні та спектрометричні методи, здатні на молекулярному рівні визначати структуру і склад ізольованих сполук. Висока роздільна здатність та специфічність методів дозволяє не лише підтвердити цільовий метаболіт, а й виявити можливі домішки, що критично важливо для подальшого застосування у фармакології або біохімічних дослідженнях.
Первинне вилучення: надкритичні флюїди та ультразвукова екстракція
Первинне вилучення THCV із рослинної маси Cannabis sativa є ключовим етапом у забезпеченні високої вихідності та збереженні молекулярної структури цільового канабіноїду. В умовах сучасної хімічної практики найбільш ефективними та інноваційними методами вилучення вважаються надкритична флюїдна екстракція (НФЕ) та ультразвукова екстракція (УЗЕ), які дозволяють досягти високої селективності, скоротити час екстракції та мінімізувати використання токсичних розчинників.
Надкритична флюїдна екстракція базується на використанні надкритичної фази – стану речовини, коли температура і тиск перевищують критичні значення, що призводить до утворення середовища з унікальними фізико-хімічними властивостями, поєднуючими характеристики газу і рідини. Найчастіше в якості екстрагента застосовують CO₂, оскільки він нетоксичний, дешевий, безпечний для навколишнього середовища, а його критична температура (31.1 °C) і критичний тиск (73.8 бар) дозволяють проводити екстракцію при порівняно м’яких умовах, що не руйнують термолабільні сполуки.
Переваги НФЕ для вилучення THCV полягають у здатності CO₂ проникати у рослинний матрикс завдяки газоподібній дифузії, а також розчиняти неполярні і слабо полярні компоненти, до яких належить THCV. Завдяки регулюванню тиску і температури можливо варіювати щільність надкритичного CO₂, що безпосередньо впливає на розчинність і селективність по відношенню до різних канабіноїдів. Наприклад, збільшення тиску призводить до підвищення розчинності вуглеводнів і канабіноїдів, але може одночасно зменшувати селективність, що вимагає тонкого балансування параметрів. Для досягнення високої чистоти THCV НФЕ часто комбінують із використанням модифікаторів – невеликих кількостей полярних розчинників (етанол, метанол), які збільшують розчинність варінових канабіноїдів та покращують екстракцію цільових сполук.
Процес НФЕ починається з завантаження подрібненої рослинної сировини у екстрактор, де за контрольованого температурного та тискового режиму відбувається проникнення надкритичного CO₂ у матрикс і вилучення канабіноїдів. Витягнутий розчин екстракту піддається декомпресії у сепараторі, де зменшення тиску викликає конденсацію і відокремлення вилучених сполук від CO₂. Цей метод дозволяє отримати чисті екстракти без залишків розчинників, що є важливим для подальшого використання в фармацевтичних та харчових продуктах.
Ультразвукова екстракція, в свою чергу, базується на механізмі акустичної кавітації – утворенні, рості і вибуху мікропухирців у рідкому середовищі під дією ультразвукових хвиль. Цей процес викликає локальне підвищення температури і тиску, а також механічне руйнування клітинних оболонок рослинної тканини, що значно покращує проникність розчинника і виділення цільових сполук, зокрема THCV. УЗЕ є особливо ефективним для вилучення канабіноїдів із щільної, воскової рослинної матриці, де традиційні методи мацерації не дають бажаних результатів.
Ультразвукова екстракція зазвичай проводиться у суміші етанолу або його водних розчинів, які володіють відповідною полярністю для розчинення канабіноїдів. Тривалість та інтенсивність ультразвуку регулюються залежно від властивостей сировини та цільового продукту: оптимізація цих параметрів забезпечує максимальну вихідність THCV при мінімізації розкладання. Температурний режим при УЗЕ суворо контролюється для запобігання термічному руйнуванню варінових канабіноїдів, які мають нижчу термічну стабільність порівняно з класичними канабіноїдами.
Порівняльний аналіз НФЕ та УЗЕ демонструє, що надкритична екстракція забезпечує кращу селективність і чистоту екстракту, а ультразвукова – вищу швидкість і гнучкість процесу з меншими вимогами до спеціального обладнання. У багатьох випадках ці методи застосовують послідовно або у комбінації для досягнення максимальної ефективності вилучення THCV. Наприклад, ультразвукова обробка може слугувати попереднім етапом для руйнування клітинних структур перед проведенням надкритичної екстракції.
Важливим аспектом первинного вилучення є збереження кислотної форми THCV (THCVA), оскільки вона є біохімічно активною і більш стабільною формою в рослинній тканині. Неправильний температурний або хімічний режим може викликати декарбоксилювання до нейтральної форми THCV, що змінює фармакологічні властивості та впливає на кінцевий склад екстракту. Тому параметри НФЕ і УЗЕ налаштовуються для мінімізації таких перетворень.
Методологічні дослідження також фокусуються на масштабуванні процесів НФЕ та УЗЕ для промислового виробництва, що вимагає збереження високої селективності при значних обсягах сировини. Використання автоматизованих систем контролю тиску, температури та потоку розчинника забезпечує стабільність і повторюваність вилучення THCV, що є важливим для стандартизації фармацевтичної сировини.
Хроматографічні підходи до очищення: HPLC з діодно-матричним детектором
Високоефективна рідинна хроматографія (HPLC) з діодно-матричним детектором (DAD) є основним інструментом для очищення та аналізу канабіноїдів, зокрема THCV, на стадії після первинного вилучення. Цей метод відзначається високою роздільною здатністю, чутливістю, можливістю спектральної ідентифікації компонентів у складних сумішах, а також адаптивністю до масштабування процесів очищення в лабораторних і промислових умовах.
Ключовою характеристикою HPLC є використання колонок із різними типами наповнювачів, що забезпечують селективне розділення молекул за їх хімічними та фізичними властивостями. Для канабіноїдів, включно з THCV, оптимальними є колонки зі зворотно-фазовою силіконовою матрицею, що мають стабільні C18-групи. Така фаза взаємодіє гідрофобно з неполярними ділянками молекул, що дозволяє розділяти варінові та класичні канабіноїди за ступенем гідрофобності, довжиною бічних ланцюгів і функціональними групами. Специфікація колонки (розмір частинок, довжина та діаметр) критично впливає на роздільну здатність і час аналізу.
У процесі очищення вихідний екстракт після первинного вилучення розчиняється у сумісному з рухомою фазою розчиннику (найчастіше суміші води з метанолом або ацетонітрилом), що дозволяє уникнути випадіння осаду і забезпечує однорідність введення в колонку. Рухома фаза зазвичай є градієнтною, що означає поступове зміщення співвідношення полярних і неполярних розчинників протягом хроматографічного проходження, що суттєво підвищує роздільну здатність для складних сумішей канабіноїдів.
Діодно-матричний детектор у складі HPLC дозволяє отримувати спектри поглинання у широкому діапазоні довжин хвиль для кожного елюату. Це важливо для ідентифікації THCV, оскільки він має специфічний спектр поглинання, відмінний від інших канабіноїдів через варінову бічну ланцюгову групу. Детектор фіксує повний спектр, що дозволяє виявити наявність суміжних сполук, а також контролювати чистоту фракції, що збирається. Це дає змогу уникати перехрещування піків, характерних для сумішей канабіноїдів з подібною хроматографічною поведінкою.
Критичною є оптимізація параметрів роботи HPLC – швидкість рухомої фази, температура колонки, обсяг введення зразка. Зниження швидкості рухомої фази підвищує роздільну здатність, але збільшує час аналізу, тому вибір режиму залежить від цілей: аналітичний чи підготовчий. Температура колонки впливає на в’язкість рухомої фази та взаємодії між молекулами канабіноїдів і стаціонарною фазою, що впливає на ретенцію і пікову форму. При очищенні THCV рекомендується підтримувати температуру 30-40 °C для збереження стабільності та оптимального розділення.
Використання HPLC-DAD у режимі preparative chromatography забезпечує збір фракцій із високим ступенем чистоти THCV. Після розділення пікові зони, ідентифіковані спектральними даними, збирають у фракційні контейнери для подальшої концентруючої обробки або використання у дослідженнях. Для масштабування застосовують колонки більшого діаметру та автоматизовані системи збору, що дозволяє одночасно підтримувати якість і обсяги отримуваного продукту.
Додатково, HPLC-DAD забезпечує контроль якості на різних етапах технологічного процесу вилучення THCV: від моніторингу ефективності первинної екстракції, перевірки ступеня очищення після проміжних операцій, до остаточної валідації чистоти кінцевого препарату. Ця універсальність робить метод незамінним у фармацевтичній індустрії, де критично важливо отримати стандартизований продукт з фіксованим вмістом THCV.
Метод також дає змогу виявляти і кількісно оцінювати домішки, такі як канабігерол (CBG), канабіхромен (CBC) і кислоти-прекурсори (THCVA, CBGA), що є необхідним для подальшої стандартизації та контролю безпеки препарату. Спектральна селективність DAD дозволяє відрізнити ізомери, які мають схожі хроматографічні властивості, що є суттєвою перевагою при роботі з комплексними матрицями.
Одним із викликів у використанні HPLC-DAD є необхідність налаштування методу під специфіку THCV, зокрема через низьку концентрацію канабіноїду у багатьох зразках. Для цього застосовують попереднє концентрування екстракту, оптимізацію градієнта розчинника і вибір колонки з підвищеною селективністю. Також важливо враховувати стабільність THCV під час інжекції та розділення, тому проводяться дослідження оптимального рН рухомої фази, що мінімізує деградацію.
Інноваційні підходи включають комбінацію HPLC з іншими детекторами (флуоресцентним, мас-спектрометричним) для підвищення чутливості та специфічності аналізу, але саме DAD залишається базовим і доступним варіантом для промислової практики. Його перевага полягає у швидкому отриманні спектральної інформації і можливості одночасного моніторингу декількох довжин хвиль, що дозволяє розширити аналітичний діапазон і підвищити якість ідентифікації.
Спектрометричні методи підтвердження чистоти: LC-MS/MS та ЯМР
Спектрометричні методи є критично важливими у процесах аналізу та підтвердження чистоти екстрактів THCV, особливо у фармацевтичних і наукових дослідженнях, де точність і специфічність ідентифікації відіграють ключову роль. Поєднання рідинної хроматографії з подвійним мас-спектрометричним детектуванням (LC-MS/MS) та ядерного магнітного резонансу (ЯМР) формує золотий стандарт для комплексного аналізу канабіноїдів, зокрема THCV, завдяки їх унікальним аналітичним властивостям.
LC-MS/MS базується на поєднанні хроматографічного розділення суміші з мас-спектрометричним визначенням молекулярних мас і структурних фрагментів. У контексті THCV, LC забезпечує ефективне відокремлення канабіноїду від інших канабіноїдів, домішок та побічних продуктів екстракції. Критичним аспектом є використання подвійного мас-спектрометричного детектора, що дозволяє реалізувати два рівні аналізу: первинне сканування молекулярної маси (MS1) та вторинне фрагментне сканування (MS2). Такий підхід дає змогу отримати детальний спектр ідентифікації за унікальними іонними фрагментами, що є характерними для THCV, та підтвердити його структуру навіть у складних матрицях.
Однією з найбільших переваг LC-MS/MS є висока селективність і чутливість, що дозволяє виявляти THCV у низьких концентраціях із точністю до пікограмів на мілілітр. Також метод дозволяє розрізняти ізомери канабіноїдів, які мають однакову молекулярну масу, але різну структуру, завдяки специфічним паттернам фрагментації. Це важливо при аналізі екстрактів, де присутні канабігеровари, канабідіол та інші канабіноїди, оскільки їхня точна ідентифікація є необхідною для підтвердження чистоти THCV.
Підготовка зразків для LC-MS/MS передбачає очищення від домішок, сумісних із рухомою фазою розчинників і оптимізацію концентрації, що дозволяє мінімізувати матричні ефекти, які можуть спотворювати результати. У ході аналізу рухома фаза зазвичай включає градієнтний режим із використанням сумішей води і органічних розчинників (метанолу або ацетонітрилу) з додаванням буферів, що стабілізують іони у плазмі і підвищують відтворюваність результатів.
Ядерний магнітний резонанс (ЯМР) доповнює мас-спектрометрію, надаючи інформацію про молекулярну структуру на атомному рівні. Для THCV ЯМР дозволяє однозначно підтвердити конфігурацію варінової бічної групи, розташування функціональних груп і хімічне оточення протонів і вуглеців у молекулі. Спектроскопія ЯМР базується на взаємодії магнітних моментів ядер із зовнішнім магнітним полем, що породжує характерні спектри за частотою резонансу, які унікальні для кожного типу атомів у певному хімічному оточенні.
Для аналізу THCV застосовують протонний (^1H) та вуглецевий (^13C) ЯМР. Протонний ЯМР дає можливість ідентифікувати кількість і типи водневих ядер, їх хімічні зсуви, спін-спінові взаємодії (сплітінг), що відображає точну структуру молекули. Вуглецевий ЯМР доповнює картину за рахунок визначення середовища атомів вуглецю. Сучасні методи двовимірного ЯМР (COSY, HSQC, HMBC) дозволяють побудувати детальну карту взаємодій між ядрами, що є незамінним для повної структурної ідентифікації THCV.
Застосування ЯМР у поєднанні з LC-MS/MS підвищує достовірність ідентифікації THCV, особливо в випадках, коли можливі структурні ізомери або сліди домішок. ЯМР не лише підтверджує молекулярну структуру, але й оцінює ступінь чистоти, оскільки домішки дають окремі сигнали, що можуть бути виявлені при високій роздільній здатності спектрометра. Для підвищення точності аналізу використовують стандартизовані умови зразка, включаючи розчинники та концентрації, а також калібрувальні стандарти.
Значною перевагою LC-MS/MS є можливість кількісного визначення THCV із високою точністю та чутливістю. Кількісний аналіз заснований на використанні ізотопних внутрішніх стандартів і побудові калібрувальних кривих, що забезпечує відтворюваність і точність результатів у широкому діапазоні концентрацій. LC-MS/MS є також незамінним при перевірці стабільності THCV у зразках під час зберігання і обробки.
Важливим аспектом є інтеграція спектрометричних методів у стандартизовані протоколи контролю якості фармацевтичних продуктів на основі THCV. LC-MS/MS та ЯМР використовуються не тільки для підтвердження ідентичності і чистоти, а й для виявлення потенційних деградаційних продуктів, контамінантів та синтетичних домішок, що гарантує безпеку та ефективність кінцевого препарату.
Технічні вимоги до обладнання високі: мас-спектрометри повинні мати точність масового аналізу до часток мілідамаса, а ЯМР-спектрометри – стабільне магнітне поле і високу чутливість. Це дозволяє не лише виявляти THCV у низьких концентраціях, а й проводити складні структурні дослідження, включно з визначенням стереоізомерії.
Сучасні технології передбачають автоматизацію збору, обробки та інтерпретації даних LC-MS/MS і ЯМР, що значно підвищує продуктивність аналітичних лабораторій і забезпечує швидкість прийняття рішень у виробництві та контролі якості. Програмні комплекси дозволяють ідентифікувати канабіноїди за багатовимірними спектральними ознаками, мінімізуючи людський фактор і помилки.
Фармакодинаміка та біологічна активність
Фармакодинаміка THCV є багатогранною і характеризується складною взаємодією з ендоканабіноїдною системою організму, що включає не лише класичні рецептори CB1 і CB2, але й низку додаткових мішеней, що впливають на широкий спектр фізіологічних процесів. THCV, як канабіноїд із структурною відмінністю у варіновому боковому ланцюзі, проявляє унікальні фармакологічні властивості, що відрізняються від класичного Δ9-тетрагідроканабінолу (THC), і тому його біологічна активність заслуговує окремого детального розгляду.
Перш за все, THCV демонструє здатність впливати на ендоканабіноїдну систему із властивостями, які можна класифікувати як частковий агоніст або антагоніст, залежно від концентрації та специфічності рецепторів. Його взаємодія із CB1-рецепторами, переважно локалізованими у центральній нервовій системі, має складний характер, який суттєво впливає на нейрофізіологічні функції, включно з регуляцією апетиту, болю, моторики та когнітивних процесів. Цей ефект значно відрізняється від потужного агонізму THC, що робить THCV потенційно корисним як регулятор із мінімальними психоактивними ефектами.
На рівні периферії, THCV взаємодіє з CB2-рецепторами, що представлені переважно у імунній системі, лімфоїдній тканині та в деяких органах. Вплив на CB2 сприяє імуномодулюючій дії, що проявляється у здатності знижувати запальні процеси та впливати на імунний відповідь. THCV виявляє потенціал для використання у терапії захворювань із запальною етіологією, що зумовлено його здатністю модулювати активність цитокінів і проліферацію імунних клітин.
Крім взаємодії з канабіноїдними рецепторами, THCV впливає на інші рецепторні системи, зокрема TRPV1 (транзіторний потенціал ванілоїдного рецептора 1), GPR55 та PPAR-гамма, що розширює його фармакологічний профіль і робить його вплив більш комплексним. Через активацію TRPV1 відбувається регуляція больових сигналів і терморегуляції, що робить THCV перспективним у контексті анальгетичної терапії. Взаємодія з GPR55 також пов’язана з регуляцією метаболічних процесів і потенційно має значення для лікування метаболічних синдромів.
Психофармакологічна активність THCV відрізняється від THC через відсутність сильного психоактивного впливу, що пояснюється частковою антагоністичною дією на CB1-рецептори при низьких концентраціях. Ця властивість створює можливості для використання THCV у клінічній практиці як засобу, що знижує апетит і сприяє контролю ваги без характерних психоактивних ефектів THC. Дослідження на тваринних моделях показують, що THCV сприяє зниженню маси тіла та покращенню метаболічних параметрів, включно з глюкозною толерантністю та інсуліновою чутливістю.
Крім того, THCV впливає на нейротрансмісійні процеси, зокрема регулюючи вивільнення дофаміну в мозку, що має значення для розробки терапії нейродегенеративних захворювань, таких як Паркінсонова хвороба. Механізм дії пов’язаний із модулюванням синаптичної передачі у відповідних ділянках мозку, що впливає на моторні функції та когнітивні процеси. Протизапальна та нейропротекторна активність THCV проявляється також у здатності знижувати оксидативний стрес і апоптоз нейронів, що робить його перспективним у дослідженнях для лікування різних нейродегенеративних патологій.
На рівні серцево-судинної системи THCV впливає на судинний тонус і регулює артеріальний тиск через механізми, які включають активацію PPAR-рецепторів і зниження вивільнення прозапальних факторів. Це створює підґрунтя для потенційного застосування THCV у кардіопротекції та як засобу, що знижує ризик атеросклерозу та пов’язаних з ним ускладнень.
Додатково THCV проявляє антимікробні властивості, які були підтверджені в низці досліджень in vitro, де він показав здатність пригнічувати ріст грампозитивних бактерій, включно з резистентними штамами. Ця активність пов’язана з його ліпофільністю та здатністю втручатися у мембранні процеси мікроорганізмів.
Варто також зазначити здатність THCV впливати на процеси апоптозу та проліферації в ракових клітинах, що відкриває перспективи для досліджень у галузі онкології. Попередні дослідження свідчать про індукцію апоптозу через активацію канабіноїдних рецепторів і модуляцію сигнальних шляхів, включно з MAPK та PI3K/Akt, що визначає потенційне застосування THCV як ад’ювантної терапії у лікуванні деяких типів пухлин.
Агоністичні та антагоністичні властивості щодо CB1 та CB2
Дельта-9-тетрагідроканабіварин (THCV) демонструє унікальний профіль взаємодії з канабіноїдними рецепторами CB1 і CB2, що відрізняється від класичного Δ9-THC, що робить його фармакологічно цікавим об’єктом досліджень. Механізми агонізму та антагонізму THCV мають високу специфічність і обумовлюють різні біологічні ефекти, залежно від концентрації, типу рецептора та тканини, де рецептори експресуються.
Щодо CB1-рецептора, локалізованого переважно у центральній нервовій системі, THCV проявляє двофазний ефект: при низьких концентраціях він діє як конкурентний антагоніст або частковий антагоніст, тоді як при вищих дозах – як частковий агоніст. Ця доза-залежна дихотомія пояснюється здатністю THCV зв’язуватися з активним центром рецептора, блокуючи або пом’якшуючи ефекти агоністів, таких як Δ9-THC, водночас за певних умов частково активуючи рецептор. Конкурентний антагонізм при низьких концентраціях призводить до зниження гіперполяризації нейронів, що зв’язана з гальмуванням передачі сигналів через CB1, та зменшує психоактивні ефекти, пов’язані з THC. Також виявлено, що антагоністичний ефект THCV на CB1-рецептори має значення у регуляції апетиту, сприяючи його пригніченню, що використовується у дослідженнях з лікування ожиріння.
На відміну від THC, який є потужним агоністом CB1, THCV не викликає вираженої психоактивності, що пояснюється його властивістю обмежувати надмірну активацію CB1-рецепторів. Експериментальні дослідження на тваринах підтверджують, що THCV модулює поведінкові ефекти, пов’язані з CB1, включно зі зменшенням моторної активності, але без класичних психостимулюючих проявів THC. Така поведінкова модифікація пов’язана з селективною антагонією на CB1-рецепторах у ділянках мозку, відповідальних за координацію і мотивацію.
Щодо CB2-рецепторів, які головним чином представлені в імунних клітинах, THCV виступає переважно як частковий агоніст, що активує сигнальні шляхи, пов’язані з імунною відповіддю. Ця активація супроводжується регуляцією секреції цитокінів, інгібуванням проліферації макрофагів і моноцитів, а також посиленням антивоспалювальних процесів. В результаті THCV сприяє зниженню запальної відповіді в моделях імунозапалення, що вказує на його потенціал як імуномодулюючого агента. Частковий агонізм до CB2-рецепторів дозволяє знизити запалення без імуносупресивних ефектів, характерних для повних агоністів.
Інші аспекти взаємодії THCV з CB2 включають здатність впливати на хемотаксис і міграцію імунних клітин, що має значення у контексті автоімунних і запальних захворювань. THCV може модулювати відповіді імунних клітин, змінюючи експресію прозапальних молекул, таких як TNF-α та інтерлейкіни, що підкреслює його терапевтичний потенціал у патогенезі запальних процесів.
Крім того, фармакодинамічний профіль THCV на CB1 та CB2 має важливі відмінності у тканинній експресії. У центральній нервовій системі THCV діє переважно як антагоніст CB1, тоді як у периферичних тканинах імунної системи – як агоніст CB2, що дозволяє йому поєднувати нейропротекторні та імуномодулюючі властивості. Такий селективний вплив на рецептори в різних системах створює фундамент для багатогранних терапевтичних застосувань.
Молекулярні дослідження показали, що THCV має високий афінний зв’язок до CB1 і CB2 у порівнянні з іншими канабіноїдами, проте відмінність полягає у конформаційних змінах рецептора, що викликаються його зв’язуванням. THCV індукує менш стабільний активний стан CB1, ніж THC, що пояснює частковий агонізм і антагонізм, і підтримує його роль як модулятора рецепторної активності. Внаслідок цього, THCV може виступати як “функціональний антагоніст”, блокуючи надмірну стимуляцію рецепторів без повного їх вимикання.
Дослідження у клінічних моделях підтвердили, що THCV знижує ефекти THC, зокрема психомоторні і психоактивні прояви, що відкриває перспективи для використання у комбінації із THC для пом’якшення побічних ефектів останнього. Такий вплив особливо актуальний для медичного канабісу, де баланс між терапевтичною ефективністю і психоактивністю є критичним.
Особливістю THCV є його вплив на гетеродимеризацію CB1 та CB2 з іншими рецепторами, зокрема TRPV1 і GPR55, що модулює загальну рецепторну активність і додає нові рівні регуляції. Взаємодія з CB1/CB2 у складі рецепторних комплексів забезпечує регуляцію різних сигнальних каскадів, таких як аденілатциклаза, MAP-кінази і фосфоліпаза C, що визначає широкий спектр біологічних реакцій.
Важливо зазначити, що вплив THCV на CB1 і CB2 рецептори демонструє виразну селективність щодо їх субтипів та рецепторних аллостеричних сайтів. Це відкриває можливість розробки специфічних лігандів на основі THCV з метою тонкої настройки рецепторної активності в терапевтичних застосуваннях.
Модуляція енергетичного метаболізму та глюкозного обміну
Дельта-9-тетрагідроканабіварин (THCV) займає унікальне місце серед канабіноїдів завдяки своїй здатності регулювати енергетичний метаболізм і глюкозний обмін через складні механізми, що виходять за межі простого впливу на рецептори CB1 і CB2. Ця молекула демонструє здатність безпосередньо впливати на метаболічні шляхи, пов’язані з контролем апетиту, інсуліновою чутливістю, а також регуляцією глюкозного гомеостазу.
Основним механізмом, через який THCV впливає на енергетичний обмін, є його антагоністична дія на CB1-рецептори, які відіграють ключову роль у регуляції апетиту і метаболізму ліпідів. Зниження активації CB1 призводить до пригнічення ліпогенезу у жировій тканині та печінці, зменшення накопичення жиру, а також до посилення ліполізу. Ці зміни супроводжуються підвищенням витрати енергії і активацією мітохондріального дихання, що сприяє більш ефективному використанню енергетичних резервів організму. Внаслідок цього THCV може сприяти зниженню маси тіла та поліпшенню метаболічного профілю, що особливо актуально при синдромі метаболічного синдрому та ожирінні.
Крім того, THCV впливає на секрецію інсуліну та чутливість тканин до нього. Експериментальні моделі показали, що THCV підвищує здатність підшлункової залози до продукування інсуліну, одночасно покращуючи відповідь периферичних тканин, таких як скелетні м’язи і печінка, на інсуліновий сигнал. Це підсилює захоплення глюкози клітинами, знижуючи рівень глікемії в крові. Важливо, що THCV не індукує гіпоглікемію при нормальному рівні глюкози, що свідчить про регулюючу, а не агресивну дію.
Важливим аспектом модуляції глюкозного метаболізму є вплив THCV на AMP-активовану протеїнкіназу (AMPK) – ключовий сенсор енергетичного стану клітини. THCV активує AMPK у печінці та м’язах, що сприяє зменшенню синтезу жирних кислот і глюконеогенезу, а також посилює окиснення жирів. Цей вплив призводить до покращення метаболічного балансу та зниження рівня тригліцеридів у крові. Посилення AMPK-активності також асоціюється зі зменшенням оксидативного стресу, що важливо для попередження ускладнень при діабеті 2 типу.
Окрім впливу на CB1, THCV здійснює модуляцію інших сигнальних шляхів, пов’язаних із метаболізмом. Зокрема, він активує пероксисомальний пролифератор-активований рецептор гамма (PPARγ), що сприяє підвищенню чутливості тканин до інсуліну і регуляції ліпідного обміну. Активність PPARγ під впливом THCV знижує експресію прозапальних цитокінів, таких як IL-6 і TNF-α, що зменшує хронічне запалення, пов’язане з інсулінорезистентністю. Цей комплексний вплив на імунометаболічні механізми підсилює загальне позитивне дію THCV при метаболічних розладах.
Взаємодія THCV із рецептором GPR55 також має значення у регуляції метаболізму. GPR55, що часто розглядається як “третій” канабіноїдний рецептор, бере участь у контролі клітинного росту та гомеостазу ліпідів. THCV може функціонувати як антагоніст GPR55, що впливає на зменшення проліферації адипоцитів та посилення окислювального метаболізму, сприяючи подоланню ожиріння та метаболічного синдрому.
Дослідження на тваринах свідчать, що THCV поліпшує параметри толерантності до глюкози та інсулінової чутливості, знижує апетит і водночас збільшує енерговитрати, що разом призводить до стабілізації маси тіла. Особливо виражені ці ефекти у моделях ожиріння, спричиненого дієтою з високим вмістом жирів, де THCV запобігає розвиткові гіперглікемії та інсулінорезистентності. Ці результати підтверджують терапевтичний потенціал THCV у лікуванні діабету 2 типу.
Крім прямої модуляції рецепторів, THCV впливає на метаболізм через регуляцію ендоканабіноїдної системи (ECS) в цілому. Порушення балансу ECS пов’язане з патологіями метаболізму, такими як ожиріння та діабет. THCV стабілізує рівень основних ендоканабіноїдів (анандаміду та 2-AG), впливаючи на ферменти їх синтезу та деградації, що додатково регулює енергетичний гомеостаз.
Значною є роль THCV у впливі на мозкові центри контролю апетиту. Він модулює активність гіпоталамічних нейронів, що відповідають за голод та ситість, змінюючи вивільнення нейропептидів, таких як NPY (нейропептид Y) та POMC (проопіомеланокортин). Це впливає на поведінкові реакції, знижуючи споживання їжі без виникнення компенсаційного переїдання, що свідчить про довготривалу регуляцію енергетичного балансу.
На рівні клітинних мембран THCV може впливати на активність іонних каналів та кальцієвих потоків, які беруть участь у внутрішньоклітинній передачі сигналів, пов’язаних з метаболічними процесами. Зокрема, модулюється робота TRPV1-рецепторів, що бере участь у терморегуляції та метаболічній адаптації, що є додатковим фактором у регуляції енергетичного обміну.
Ефекти THCV в контексті глюкозного обміну включають вплив на глюкозотранспортні білки GLUT4 та GLUT2, що забезпечують транспортування глюкози в периферичні тканини. Під впливом THCV підвищується експресія цих транспортерів, що сприяє ефективнішому засвоєнню глюкози і підтримці глікемічної стабільності. Особливо це важливо для м’язової тканини і печінки, де відбувається більша частина обміну глюкози.
У комплексі THCV виступає як потужний модулятор енергетичного гомеостазу, що охоплює впливи на рецептори канабіноїдної системи, імунометаболічні шляхи, мітохондріальну функцію, іонні канали, транспортери глюкози та нейрональну регуляцію апетиту. Його здатність одночасно покращувати інсулінову чутливість, знижувати апетит, стимулювати ліполіз і регулювати енергетичний баланс робить його перспективним кандидатом для розробки препаратів, спрямованих на лікування метаболічних синдромів, цукрового діабету 2 типу та ожиріння, де існує потреба у точній модуляції метаболічних процесів без побічних психоактивних ефектів.
Потенційні напрями застосування
Дельта-9-тетрагідроканабіварин (THCV) демонструє широке коло фармакологічних властивостей, що дозволяють розглядати його як багатофункціональну терапевтичну молекулу у низці патологічних станів, які не обмежуються ендоканабіноїдною системою. На відміну від багатьох інших фіто- і синтетичних канабіноїдів, THCV має унікальне поєднання селективної біоактивності, відсутності психоактивних ефектів у терапевтичних дозах, а також високого профілю безпеки, що відкриває нові горизонти його застосування в персоналізованій фармакотерапії.
Одним із перспективних напрямів дослідження є використання THCV при захворюваннях, пов’язаних із порушенням регуляції внутрішньоклітинного кальцієвого гомеостазу. Завдяки модуляції каналів TRP-родини (зокрема, TRPV1 і TRPA1), THCV може впливати на сигнальні шляхи, які контролюють збудливість нейронів, вазодилатацію, а також механізми ноцицепції. Це формує підґрунтя для його потенційного застосування при хронічному болю центрального та периферичного генезу, невропатичних синдромах та навіть функціональних болях у межах соматоформних розладів.
Ще одним ключовим напрямом є дослідження ефективності THCV у патологіях, пов’язаних із порушенням роботи мітохондрій. Дослідницькі дані свідчать, що THCV потенційно здатний впливати на мітохондріальний біогенез і оксидативний фосфорилювання, опосередковано активуючи сигнальні шляхи через AMPK і SIRT1. Це відкриває можливості для його застосування в лікуванні нейродегенеративних хвороб, таких як хвороба Альцгеймера, Паркінсона, а також при хронічній втомі, саркопенії та метаболічно-індукованому м’язовому виснаженні.
Інтерес також викликає потенційне використання THCV при порушеннях циркадних ритмів. Відомо, що ендоканабіноїдна система тісно пов’язана з регуляцією сну, температурного ритму, гормональної секреції. У цьому контексті THCV, не викликаючи седативних або стимулюючих ефектів, може впливати на експресію генів годинника (clock genes), зокрема Bmal1, Clock і Per2, що відкриває можливості застосування в хронобіологічній терапії без ризику порушення добового ритму.
На рівні серцево-судинної системи THCV демонструє здатність модулювати судинний тонус і функцію ендотелію через взаємодію з GPR55, а також опосередкований вплив на синтез оксиду азоту. Протидія ендотеліальній дисфункції, зниження оксидативного стресу і регуляція артеріального тиску можуть бути корисними при гіпертонії, атеросклерозі та ішемії. Крім того, в експериментах in vitro THCV сприяв покращенню реологічних властивостей крові та зниженню тромбоцитарної агрегації, що підкреслює його потенціал у профілактиці тромботичних ускладнень.
У сфері психіатрії THCV розглядається як перспективний кандидат для терапії психотичних розладів, зокрема при шизофренії та біполярному афективному розладі. Механізми такої дії включають непряму модуляцію допамінергічної активності через вплив на CB1 і GPR55, а також нормалізацію глутаматергічного обміну. Важливим є факт, що на відміну від Δ9-THC, THCV не посилює психотичну симптоматику, а навпаки, чинить антипсихотичний ефект у експериментальних моделях, не викликаючи дизфорії чи залежності. Це робить його привабливим варіантом для створення нових психотропних засобів із поліпшеним профілем безпеки.
Окрема увага приділяється перспективам використання THCV у дерматології. Його вплив на кератиноцити, себоцити та імунні клітини шкіри через рецептори CB1, CB2, GPR55 і TRPV1 дозволяє розглядати цю молекулу як можливий засіб для лікування таких хвороб, як акне, псоріаз, атопічний дерматит. Завдяки протизапальним властивостям, антипрурітичній активності та здатності регулювати проліферацію клітин шкіри THCV може стати основою для нестероїдних зовнішніх препаратів нового покоління.
Ще один перспективний напрямок – застосування THCV у гастроентерології. Дослідження показують, що він здатен модулювати моторику шлунково-кишкового тракту, зменшувати запалення слизової оболонки, а також впливати на секрецію шлункового соку. В експериментальних моделях коліту THCV знижував інфільтрацію лейкоцитів, пригнічував продукцію IL-1β і TNF-α, що свідчить про потенціал у терапії запальних захворювань кишечника, таких як хвороба Крона або виразковий коліт.
Не менш важливою є перспектива використання THCV у контексті онкологічної терапії. Незважаючи на обмеженість клінічних даних, існують попередні експериментальні свідчення про здатність THCV впливати на проліферацію та апоптоз пухлинних клітин різного походження. Його антипроліферативна активність виявлена в клітинах гліоми, карциноми передміхурової залози та молочної залози. Потенційна дія реалізується через модуляцію сигнальних шляхів PI3K/Akt/mTOR, що грають ключову роль у клітинній проліферації та виживанні.
У межах спортивної медицини та реабілітації також простежується потенціал застосування THCV як адаптогенного агента з впливом на м’язову витривалість, оксидативний обмін і відновлення після фізичного навантаження. Його здатність зменшувати запалення та окислювальний стрес у скелетних м’язах, а також знижувати рівень креатинфосфокінази після надмірного навантаження відкриває шлях до створення продуктів для спортивного відновлення без заборонених стимуляторів.
Метаболічний синдром і контроль апетиту
Дельта-9-тетрагідроканабіварин (THCV) привертає особливу увагу в контексті метаболічного синдрому завдяки здатності модуляторно впливати на центральні й периферичні механізми, що регулюють енергетичний баланс, ліпідний профіль та апетитогенез. На відміну від класичних агоністів канабіноїдних рецепторів, які сприяють гіперфагії та набору маси тіла, THCV діє зворотньо – проявляючи анорексигенну активність та впливаючи на метаболічні сигнальні каскади, пов’язані з інсулінорезистентністю, гіперглікемією та дисліпідемією.
Ключовим механізмом є його антагоністичний вплив на CB1-рецептори гіпоталамуса, що локалізуються у ядрах arcuatus, paraventricular та ventromedial – основних центрах контролю апетиту. Блокування ендоканабіноїдної активності в цих зонах призводить до зменшення експресії нейропептиду Y (NPY) та агуті-пов’язаного пептиду (AgRP), які стимулюють харчову поведінку, і водночас підвищує активність POMC-нейронів, які індукують насичення через вивільнення α-MSH. Таким чином, THCV не лише знижує бажання до їжі, але й змінює нейрохімічну реактивність до калорійного навантаження.
Окрім впливу на гіпоталамічні структури, THCV чинить модулюючу дію на периферичні сигнальні шляхи, пов’язані з регуляцією секреції інсуліну та чутливості до нього. У моделях ожиріння з індукованою інсулінорезистентністю THCV демонстрував зниження глікемії натще, покращення толерантності до глюкози, а також посилення інсулін-індукованого фосфорилювання рецепторів IR та подальшої активації PI3K/Akt-шляху. Це свідчить про його потенціал у корекції порушеного інсулінового сигналінгу при цукровому діабеті 2 типу в контексті метаболічного синдрому.
На рівні гепатоцитів і адипоцитів THCV демонструє здатність впливати на експресію генів, залучених до ліпогенезу та ліполізу. Зокрема, пригнічується активність ферментів ACC (ацетил-КоА-карбоксилаза) та FAS (синтаза жирних кислот), що обмежує синтез тригліцеридів, водночас стимулюється експресія HSL (гормон-чутливої ліпази) та ATGL (адипоцитарної тригліцеридліпази), що посилює мобілізацію ліпідних резервів. Це веде до зменшення маси жирової тканини, зниження вісцерального ожиріння та нормалізації рівня лептину, який у хворих із метаболічним синдромом часто втрачає функціональну активність через лептинорезистентність.
У гіпоталамічно-гіпофізарно-наднирковій осі THCV чинить регуляторний вплив на вивільнення кортизолу через інгібування CRH (кортикотропін-рилізинг гормону) та модуляцію глюкокортикоїдних рецепторів. Це важливо з огляду на те, що хронічна гіперкортизолемія є одним з ключових компонентів метаболічного синдрому, зумовлюючи інсулінорезистентність, підвищення глюконеогенезу та накопичення жиру в черевній ділянці. Таким чином, THCV сприяє нормалізації гормонального профілю при стрес-залежному наборі ваги.
Також важливим є вплив THCV на адекватну реакцію клітин на адипокіни. У дослідженнях на культурах адипоцитів показано, що під впливом THCV підвищується експресія рецепторів до адипонектину – пептиду з вираженими інсулінсенсибілізуючими властивостями. Це супроводжується покращенням клітинної відповіді на інсулін і зниженням продукції прозапальних цитокінів, зокрема TNF-α та IL-6, які є медіаторами хронічного субклінічного запалення у хворих на метаболічний синдром.
Значну увагу також привертає вплив THCV на гастроінтестинальні гормони. У моделі нутрієнтної стимуляції спостерігалося підвищення вивільнення глюкагоноподібного пептиду-1 (GLP-1) та пептиду YY (PYY), що супроводжується подовженням відчуття ситості, зниженням швидкості випорожнення шлунка та зменшенням калорійного споживання. Вказані механізми наближають дію THCV до механізмів сучасних інкретинових препаратів, однак з мінімальним впливом на артеріальний тиск і без побічної дії на серцево-судинну систему.
У контексті мозкових структур, пов’язаних із дофамінергічним підкріпленням (мезолімбічний шлях), THCV знижує стимуляцію дофамінових рецепторів D1 і D2, що бере участь у формуванні харчової залежності. Це має особливе значення для пацієнтів із компульсивним переїданням, які втрачають контроль над апетитом у відповідь на зовнішні або емоційні тригери. Зниження гедоністичної відповіді на їжу під дією THCV може бути використане як підхід до формування нових стратегій лікування залежної поведінки, пов’язаної з харчуванням.
Також продемонстровано, що THCV позитивно впливає на склад мікробіоти кишечника, зокрема, сприяє підвищенню кількості бактерій родів Akkermansia та Bifidobacterium, що асоціюються зі зниженням маси тіла та покращенням інсулінової чутливості. Таким чином, з урахуванням вісцеро-мікробіотної взаємодії, THCV потенційно може використовуватись як засіб модуляції осі “кишечник-мозок” у рамках метаболічної терапії.
Протиепілептична та нейропротекторна дія
Дельта-9-тетрагідроканабіварин (THCV) виявляє багаторівневу біологічну активність у центральній нервовій системі, зокрема демонструє перспективні протиепілептичні та нейропротекторні властивості, що робить його потенційним кандидатом для терапії широкого спектра неврологічних патологій, пов’язаних із гіперзбудливістю, окисним стресом і нейрозапаленням. Його дія охоплює різні молекулярні мішені, що включають іонотропні та метаботропні рецептори, транспортні системи нейромедіаторів, кальцієві канали та регуляторні білки клітинного гомеостазу.
Одним з ключових механізмів протиепілептичного ефекту THCV є його здатність модулювати активність трансмембранних іонних каналів, зокрема натрієвих та кальцієвих. У дослідженнях на нейрональних культурах показано, що THCV знижує амплітуду натрієвих струмів через пригнічення відкриття Nav1.1 та Nav1.6 – каналів, які відіграють центральну роль у генерації повторюваних потенціалів дії при фокальних нападах. Таке пригнічення супроводжується стабілізацією мембранного потенціалу та зниженням частоти деполяризацій у гіперзбуджених нейронах. Одночасно, блокада потенціал-залежних кальцієвих каналів типу T та N сприяє зниженню вивільнення глутамату – головного ексайтаторного нейромедіатора, залученого у формування судомного розряду.
Важливою мішенню є також глутаматергічна передача через рецептори NMDA та AMPA. THCV не діє як прямий антагоніст, однак опосередковано зменшує надлишкову активацію NMDA-рецепторів, знижуючи внутрішньоклітинний вхід Ca²⁺ та запобігаючи активації кальмодулін-залежної кінази II (CaMKII), що є критичною ланкою в судомній каскаді. Це дозволяє THCV запобігати формуванню глутамат-індукованої ексайтотоксичності – механізму, що лежить в основі нейрональної загибелі при епілепсії.
Значну роль у протиепілептичній активності THCV відіграє також модуляція ГАМК-ергічної інгібіції. Прямої афінності до GABA_A-рецепторів не виявлено, однак встановлено, що THCV посилює експресію генів, які кодують субодиниці α2 та γ2 рецепторів, що підвищує чутливість постсинаптичної мембрани до ГАМК. Паралельно з цим спостерігається пригнічення експресії ензиму GABA-трансамінази, що сприяє накопиченню ГАМК у синаптичній щілині. Внаслідок цього посилюється загальмованість ЦНС, що є фундаментальним фактором у запобіганні надмірної нейрональної активності при судомних станах.
THCV також здатний зменшувати експресію прозапальних цитокінів у ЦНС, зокрема TNF-α, IL-1β та IL-6, які відіграють роль у нейрозапаленні, що супроводжує епілептогенез. Цей ефект реалізується через інгібування ядерного фактора NF-κB у мікроглії – ключового транскрипційного фактору, що регулює прозапальні гени. Придушення гліального запалення перешкоджає формуванню патологічних синаптичних зв’язків та знижує ризик розвитку фармакорезистентних форм епілепсії.
У контексті нейропротекції THCV демонструє здатність пригнічувати мітохондріальну дисфункцію, що є загальним механізмом нейрональної загибелі в багатьох нейродегенеративних станах. Він стабілізує мембранний потенціал мітохондрій, знижує утворення надлишкових реактивних форм кисню (ROS) і перешкоджає активації внутрішнього шляху апоптозу через пригнічення цитохром-c-залежної активації каспаз-9 та -3. Ці ефекти було підтверджено на моделях ішемічного інсульту, гіпоксично-ішемічного ураження та нейротоксичного ураження глутаматом.
На рівні експресії генів, THCV активує сигнальні шляхи, пов’язані з виживанням нейронів – зокрема PI3K/Akt та MAPK/ERK. Це призводить до підвищення транскрипції антиапоптотичних білків, таких як Bcl-2 та BDNF (нейротрофічний фактор мозку), який не лише підтримує нейрональну пластичність, але й зменшує вразливість до ексайтотоксичних пошкоджень. Крім того, BDNF грає ключову роль у синаптичній стабільності, що має значення при хронічних епілептичних енцефалопатіях.
THCV також чинить вплив на аксональну передачу та ремієлінізацію. У дослідженнях in vitro на олігодендроцитарних прекурсорах виявлено, що він стимулює експресію генів, відповідальних за синтез мієліну (MBP, PLP1), а також знижує активність факторів демієлінізації, таких як MMP-9. Це має важливе значення у відновленні нервової тканини після епілептичних нападів, які часто супроводжуються дегенерацією білої речовини.
У клінічному аспекті THCV не демонструє психоактивного профілю, що є перевагою у порівнянні з Δ⁹-THC. Його профіль побічних ефектів виявився надзвичайно низьким, навіть у високих дозах, що дозволяє розглядати його як кандидата для хронічного застосування у випадках медикаментозно-резистентної епілепсії, особливо у дитячому віці або при супутніх когнітивних порушеннях.
Імуномодуляція та протизапальні ефекти
Дельта-9-тетрагідроканабіварин (THCV) виявляє складний і багатоаспектний вплив на імунну систему, що охоплює як інгібування прозапальних процесів, так і селективну модуляцію адаптивного імунітету. На відміну від класичних імуносупресантів, THCV діє не шляхом загального пригнічення імунної відповіді, а через точкову регуляцію ключових медіаторів запалення, сигнальних шляхів і клітинного метаболізму імунокомпетентних клітин. Такий механізм забезпечує широку перспективу використання THCV як імуномодулятора з низьким ризиком вторинної імуносупресії.
Одним із центральних механізмів імуномодулюючої дії THCV є вплив на клітини вродженого імунітету – зокрема макрофаги та дендритні клітини. В експериментах in vitro продемонстровано, що THCV значно знижує експресію Toll-подібних рецепторів (TLR2, TLR4), що відповідають за розпізнавання бактеріальних та вірусних патогенів і є ключовими тригерами каскаду запалення через активацію NF-κB. Пригнічення TLR-залежного сигналювання супроводжується зменшенням продукції цитокінів першої фази запалення – TNF-α, IL-1β, IL-6 – та інгібуванням утворення простагландинів за рахунок зниження експресії COX-2.
Крім того, THCV демонструє здатність активувати гомеостатичний фенотип макрофагів M2 через збільшення експресії IL-10 та TGF-β, що свідчить про його роль у резолюції запалення та відновленні тканин. Зміщення балансу M1/M2 у бік протизапального профілю супроводжується зменшенням рівнів оксиду азоту (NO) та інгібуванням iNOS – індуцибельної NO-синтази, яка бере участь у патологічному запаленні.
У дендритних клітинах THCV пригнічує експресію молекул ко-стимуляції CD80 та CD86, необхідних для активації наївних Т-лімфоцитів, що призводить до зменшення проліферації CD4⁺ Т-клітин та запобігає розвитку автоімунних відповідей. Крім того, THCV пригнічує експресію IL-12 – цитокіну, який індукує диференціацію Т-хелперів у Th1-клітини, що мають високий прозапальний потенціал. Це призводить до зміщення імунної відповіді у бік Th2- або Treg-фенотипу, з підвищенням рівнів IL-4 та IL-10.
Вплив THCV на адаптивний імунітет проявляється в селективній регуляції функціональної активності Т- та В-лімфоцитів. У модельних системах автоімунного енцефаломієліту та коліту було показано, що THCV знижує експресію рецепторів IL-2Rα (CD25) на активованих Т-клітинах, обмежуючи їх проліферацію та продукцію IFN-γ і IL-17 – ключових цитокінів Th1/Th17-відповіді, що відповідають за прогресію аутоімунного запалення. Одночасно спостерігається підвищення частки регуляторних Т-клітин, що зумовлює підтримання толерантності та пригнічення надмірної імунної активації.
THCV також впливає на функціональну активність В-лімфоцитів, знижуючи експресію CD40 і CD86 на їх поверхні, що обмежує антиген-презентувальну здатність цих клітин і послаблює стимуляцію Т-хелперів. У експериментальних умовах за участі ліпополісахариду (LPS) THCV значно зменшує секрецію імуноглобулінів, особливо IgG2a – підкласу, що асоціюється з хронічними запальними процесами.
Важливим аспектом протизапальної дії THCV є вплив на метаболізм імунних клітин. THCV модулює гліколітичний профіль макрофагів і Т-клітин, спрямовуючи енергетичний метаболізм від гліколізу до окисного фосфорилювання. Такий метаболічний зсув пригнічує активацію клітин через обмеження доступу до швидкої енергії, необхідної для синтезу прозапальних медіаторів. Це забезпечує енергетичний контроль над інтенсивністю імунної відповіді, що є особливо важливим у хронічних запальних процесах.
На системному рівні THCV чинить ефекти, які можуть бути реалізовані через ендоканабіноїдну систему, зокрема за рахунок модуляції сигнальних шляхів CB2-рецепторів у імунних клітинах. THCV не є класичним повним агоністом CB2, проте діє як селективний модулятор, який змінює афінність рецептора до ендогенних лігандів та впливає на внутрішньоклітинні каскади, включаючи ERK1/2, JAK/STAT та p38 MAPK. Це призводить до зниження експресії прозапальних транскрипційних факторів та підтримання фенотипу імунного гомеостазу.
Також було виявлено, що THCV знижує експресію адгезивних молекул (ICAM-1, VCAM-1) на ендотеліальних клітинах у місцях запалення, що обмежує рекрутування лейкоцитів до запального вогнища. Цей ефект має значення для профілактики тканинного ушкодження при надмірному запаленні, як-от у випадках ревматоїдного артриту чи хронічного обструктивного бронхіту.
Висновок
Комплексне дослідження Дельта-9-тетрагідроканабіварину (THCV) демонструє, що цей канабіноїд має унікальний профіль хімічної структури, біосинтезу, екологічної варіабельності, методів виділення, ідентифікації, а також фармакодинамічних і терапевтичних властивостей, які якісно відрізняють його від інших представників канабіноїдного ряду. THCV є вариновим аналогом Δ9-THC, проте на молекулярному рівні демонструє принципово іншу поведінку: від селективної взаємодії з канабіноїдними рецепторами до широкої модуляції сигнальних і метаболічних каскадів.
Його біосинтетичне походження – через декарбоксилювання тетрагідроканабіваринової кислоти (THCVA) – вказує на функціональну залежність від варинового біогенезу, який активується за специфічних генотипових і агроекологічних умов. Зокрема, THCV-селективні хемотипи, що трапляються у сортах африканського походження, є цінними джерелами для стандартизованого одержання цього сполучення.
З технологічної точки зору, оптимізація первинного вилучення та очищення THCV вимагає застосування високоселективних методів: надкритичних флюїдів для максимальної стабільності і роздільності компонентів, HPLC із діодно-матричним детектором для тонкої прецизійної очистки та LC-MS/MS і ЯМР-спектроскопії для достовірного підтвердження структурної цілісності та чистоти субстанції. Такий багаторівневий підхід до аналітики дозволяє мінімізувати ризики деградації або контамінації цільового канабіноїду.
Фармакодинамічно THCV вирізняється здатністю до біполярної дії на канабіноїдні рецептори: виступаючи як зворотний агоніст CB1 у низьких концентраціях і частковий агоніст CB2 – надає вибірковий вплив на ендоканабіноїдну регуляцію без типового психоактивного профілю Δ9-THC. Така селективність є ключовою у формуванні його терапевтичного потенціалу. Механістично THCV задіює не лише канабіноїдні рецептори, але й метаболічні шляхи, включно з AMPK, PPARγ та гліколітичними каскадами, що формує унікальну метаболотропну дію.
На рівні системного гомеостазу, THCV виконує роль багатофункціонального регулятора. Він здатен інгібувати патологічний апетит, покращувати чутливість до інсуліну, знижувати індекси ожиріння та нормалізувати плазмовий глюкозний профіль без гіпоглікемічних ефектів. Його антиконвульсивна активність, реалізована через неканабіноїдні рецептори, включає пригнічення глутаматергічної ексайтотоксичності, модуляцію кальцієвих каналів і нейропротекцію при оксидативному стресі. Імунологічно THCV діє як функціональний модулятор, пригнічуючи прозапальні цитокінові каскади, змінюючи метаболічний профіль макрофагів і підтримуючи регуляторний фенотип Т-клітин без глобальної імуносупресії.
У контексті потенційних застосувань THCV охоплює декілька високоспецифічних ніш: метаболічний синдром, контроль апетиту, епілепсія, нейродегенеративні стани, хронічне запалення й автоімунні захворювання. Важливо підкреслити, що терапевтична релевантність THCV полягає не у вузькому симптомуатичному ефекті, а в мультифакторному впливі на патофізіологічні вузли захворювання – метаболізм, імунітет, нейромедіацію. Такий системний підхід відкриває перспективи для його застосування як частини персоналізованої фармакотерапії.
Отже, THCV не є черговим мінорним канабіноїдом, а репрезентує окрему функціональну категорію біоактивних молекул із фармакологічною і технологічною унікальністю. Його дослідження має не лише фундаментальне, але й прикладне значення – у формуванні нової генерації непсихоактивних, багатофункціональних канабіноїдних препаратів із прицільною дією на ключові фізіологічні системи організму.
Джерела:
- NCBI (PubMed Central) – огляд фармакології THCV –
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2219532/ - Nature (Nutrition & Diabetes) – вплив THCV на інсулінорезистентність –
https://www.nature.com/articles/nutd201313 - British Journal of Pharmacology (Wiley Online Library) – протизапальні властивості THCV –
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/j.1476-5381.2010.00729.x - Diabetes Care (American Diabetes Association) – дослідження THCV при діабеті 2 типу –
https://care.diabetesjournals.org/content/39/2/177 - British Journal of Pharmacology (Wiley Online Library) – роль THCV у регуляції апетиту –
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/j.1476-5381.2008.00100.x - British Journal of Pharmacology (Wiley Online Library) – вплив каннабіноїдів на TRP-канали –
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/j.1476-5381.2010.01166.x - SpringerLink – хімічний склад Cannabis sativa, включно з THCV –
https://link.springer.com/chapter/10.1007/978-3-319-45541-9_1 - ScienceDirect (Pharmacology & Therapeutics) – потенційне застосування THCV при ЦНС-захворюваннях –
https://www.sciencedirect.com/science/article/pii/S0163725811001656