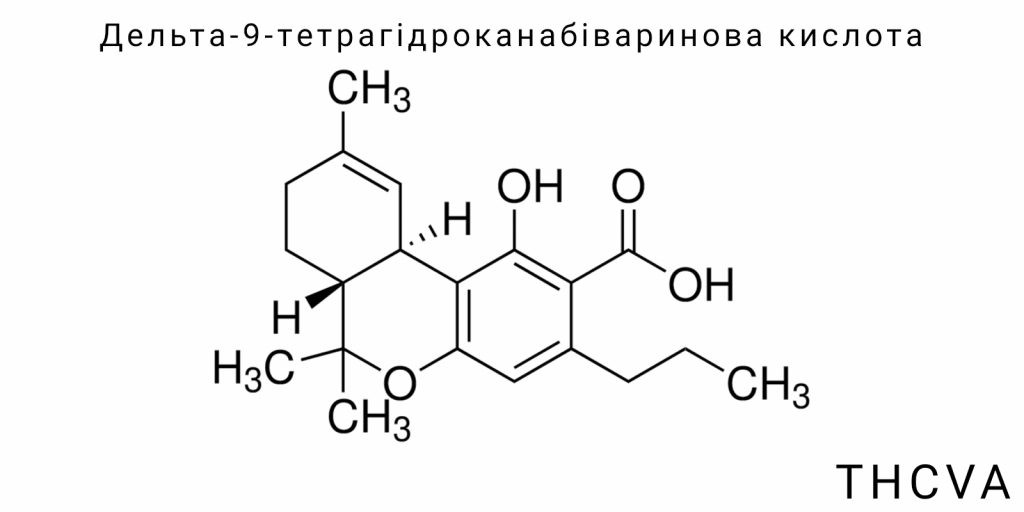
Дельта-9-тетрагідроканабіваринова кислота (THCVA) – це кислотна форма маловивченого варінового канабіноїду, яка трапляється у Cannabis sativa L. у вкрай низьких концентраціях, переважно в рослинах так званого хемотипу IV. Попри структурну подібність до дельта-9-тетрагідроканабінолової кислоти (THCA), THCVA є похідною диварінової кислоти, а не оліветолової, і має укорочений бічний ланцюг із трьома атомами вуглецю. Ця хімічна особливість істотно змінює її біологічну поведінку і фармакологічний профіль, що викликає зростаючий інтерес серед дослідників канабіноїдів.
На відміну від більш вивчених сполук канабісу, таких як Δ9-THC або CBD, THCVA лишається в тіні не лише через свою низьку природну концентрацію, а й через складність її ізоляції в стабільній кислотній формі. Канабіноїд швидко декарбоксилюється до THCV під дією температури або часу, що ускладнює кількісне визначення та функціональні дослідження самої кислотної форми. Це також частково пояснює, чому THCVA майже повністю відсутній у хроматографічних профілях оброблених або зберіганих екстрактів, і чому її не включають до фармакопейних або регуляторних стандартів більшості країн.
На молекулярному рівні THCVA утворюється через варіновий біосинтетичний каскад, що починається із взаємодії геранілпірофосфату з диваріновою кислотою, за участі специфічної тетрагідроканабіваринсинтази (THCVAS). Цей шлях є незалежним від основного оліветолового маршруту, яким синтезуються більш поширені канабіноїди. Проте наявність варінових похідних, таких як THCVA, CBVA або CBGVA, у біомасі канабісу свідчить про ширший спектр хемотипної варіабельності, ніж раніше вважалося, і має потенціал для використання як селекційний або біохімічний маркер у дослідженнях та стандартизації сировини.
Інтерес до THCVA також обумовлений його гіпотетичною фармакологічною активністю. Відомо, що декарбоксильована форма – THCV – виявляє антагонізм до CB1-рецепторів, має анорексигенні, протисудомні та протизапальні властивості. Однак фармакодинаміка кислотної форми лишається практично невивченою. Відомості про її афінність до рецепторів канабіноїдної системи, стабільність у фізіологічних умовах або біодоступність не мають експериментального підтвердження, але є важливими для розробки нових прототипів лікарських речовин, що не викликають психоактивного ефекту.
Сучасна наукова увага до кислотних форм канабіноїдів, зокрема CBDA, CBGA та THCA, стимулює інтерес до THCVA як потенційно активного компоненту, що міг бути неправильно інтерпретований або недооцінений у попередніх дослідженнях через технічні обмеження методів ідентифікації. Разом із розвитком прецизійної хроматографії, мас-спектрометрії та спектроскопії ядерного магнітного резонансу відкриваються нові можливості для відокремлення, ідентифікації та фармакологічного аналізу навіть таких нестабільних і малоконцентрованих молекул, як THCVA.
Хімічна характеристика та біогенез
Дельта-9-тетрагідроканабіваринова кислота (THCVA) належить до класу варінових канабіноїдів – вторинних метаболітів, притаманних роду Cannabis, які утворюються шляхом полікетидного біосинтезу з подальшою терпенізацією та циклізацією. Хоча THCVA є кислотною формою, яка декарбоксилюється в активну – THCV – саме кислотний варіант становить вихідну форму сполуки в сирій рослинній біомасі, і саме ця форма є хімічно стабільним продуктом ферментативного метаболізму. З точки зору канабіноїдної хеміоміки, THCVA трактується як непсихоактивний попередник, однак його структурна спорідненість до класичного Δ⁹-тетрагідроканабінолової кислоти (THCA) дозволяє припускати подібні – хоча й не ідентичні – біологічні властивості.
Хімічно THCVA класифікується як варінова кислота з трьохвуглецевим бічним ланцюгом на положенні 5 фенольного ядра, що є відмінністю від п’ятьохвуглецевої оліветолової кислоти, яка лежить в основі більшості канабіноїдів. У біосинтетичному контексті ця різниця має фундаментальне значення, оскільки вона впливає на просторову конфігурацію молекули, її гідрофобність, взаємодію з канабіноїдними рецепторами та стабільність у різних фізико-хімічних умовах. Таким чином, THCVA не є просто ізомером THCA – це окрема молекулярна категорія з притаманними лише їй біогенетичними шляхами та фізико-хімічними характеристиками.
У структурному відношенні THCVA є трициклічним терпен-фенольним похідним з наявністю карбоксильної групи, що легко декарбоксилюється під впливом тепла або часу до нейтральної молекули THCV. З огляду на це, в аналітичних цілях дослідники повинні відрізняти канабіноїдні кислоти від їх декарбоксильованих форм, зважаючи на те, що саме кислоти є переважаючими в необроблених рослинних матрицях. Це ускладнює аналітичну ідентифікацію THCVA, особливо в разі термічно обробленої, старої або екстрагованої сировини, де значна частка кислоти вже конвертована в THCV.
Згідно з поточними уявленнями про метаболізм канабісу, синтез канабіноїдів відбувається шляхом взаємодії терпенового попередника – геранілпірофосфату (GPP) – з полікетидним попередником. У випадку THCVA таким полікетидом є диварінова кислота (дивариновий еквівалент оліветолової кислоти), яка утворюється через дію полікетидсинтаз і специфічної циклози. Після конденсації GPP з диваріновою кислотою утворюється канабігероваринова кислота (CBGVA) – центральний проміжний метаболіт варінової гілки канабіноїдного біосинтезу. Цей попередник далі метаболізується специфічними синтазами, серед яких тетрагідроканабіваринова синтаза (THCVAS), що каталізує циклізацію CBGVA в THCVA.
Біогенетична специфічність THCVA також відображається в розподілі хемотипів Cannabis sativa. Було виявлено, що THCVA переважно трапляється в рослинах IV хемотипу, тобто таких, що накопичують варінові кислоти (THCVA, CBDVA, CBGVA) як основні канабіноїди, тоді як класичні THCA або CBDA переважають в I-III хемотипах. Такий розподіл зумовлений генетичними варіантами відповідних синтаз – THCVAS, CBDVAS, CBGA synthase – кожна з яких має високу субстратну селективність щодо CBGVA, а не CBG (канабігеролова кислота з п’ятьма вуглецями). Тому присутність THCVA в рослині – це не лише наслідок ферментативної активності, але й маркер генетичної конфігурації біосинтетичних ензимів.
Завдяки цим хеміотиповим відмінностям THCVA може використовуватись як селекційний маркер в генетичних програмах створення сортів з низьким вмістом Δ⁹-THC або для збагачення варіновими профілями. Наприклад, сорти з високим вмістом THCVA можуть застосовуватись у фармакології як джерело нестандартних канабіноїдів з мінімальною психоактивністю, що має принципове значення при розробці безпечних терапевтичних агентів для уразливих популяцій, таких як діти або люди з психіатричними розладами.
Особливу увагу варто звернути на фізико-хімічну стабільність THCVA. Як і всі канабіноїдні кислоти, вона є нестабільною при зберіганні, піддається автоокисленню, ізомеризації та декарбоксиляції. Це обмежує можливість її використання у фармацевтичних формах без відповідного стабілізаційного захисту або умов контролю навколишнього середовища. Однак з іншого боку, наявність карбоксильної групи у молекулі робить її більш полярною, порівняно з THCV, що відкриває можливість цілеспрямованої хроматографічної сепарації за допомогою інверсної фази або іонообмінної хроматографії.
З хімічної точки зору, THCVA може також використовуватись як модельна структура для вивчення впливу вкорочених бічних ланцюгів на активність канабіноїдів. Такі дослідження є перспективними для структурно-активнісного моделювання та створення синтетичних аналогів з оптимізованим рецепторним профілем. Уже зараз фармацевтичні компанії виявляють інтерес до непсихоактивних похідних варінового ряду, зокрема через потенційний антагонізм до CB1-рецепторів, що відкриває можливості у терапії ожиріння, діабету ІІ типу, епілепсії або нейрозапальних захворювань.
Структурна будова та класифікація
Дельта-9-тетрагідроканабіваринова кислота (THCVA) є представником специфічної підгрупи канабіноїдів, відомих як варінові канабіноїди, які характеризуються унікальною структурною особливістю – вкороченим бічним алкільним ланцюгом, що складається з трьох атомів вуглецю. Ця структурна модифікація відрізняє їх від класичних п’ятивуглецевих канабіноїдів, таких як Δ9-тетрагідроканабінолова кислота (THCA). Особливості будови THCVA не лише визначають його фізико-хімічні властивості, а й суттєво впливають на молекулярні взаємодії з біологічними мішенями, зокрема канабіноїдними рецепторами.
Хімічна структура THCVA містить три основні функціональні компоненти: фенольне кільце, циклічний терпеновий фрагмент та карбоксильну кислоту. Фенольне кільце складається з бензольного ядра з гідроксильною групою, що забезпечує молекулі полярність та можливість утворення водневих зв’язків. Цей фрагмент визначає хімічну реактивність сполуки, зокрема здатність до окиснення та кон’югації з іншими молекулами. Карбоксильна група надає THCVA кислотних властивостей, роблячи його формою, що домінує в необробленій сировині та забезпечуючи лужну розчинність. При нагріванні або під дією ферментів відбувається декарбоксилювання, що призводить до утворення нейтральної форми – THCV.
Циклічна терпенова частина молекули – це трьохчленна структура, що утворюється за участі піранового кільця, типового для канабіноїдів, що визначає тривимірну конфігурацію молекули та її здатність взаємодіяти із специфічними рецепторами в організмі. У випадку THCVA відмінністю є те, що через вкорочений бічний ланцюг зміщується конформація молекули, що має наслідком як змінений афінний профіль до рецепторів CB1 і CB2, так і потенційні відмінності в здатності проходити крізь біологічні бар’єри.
Класифікація THCVA у хімічному контексті відбувається за кількома критеріями. По-перше, за структурою вона належить до фенолікарбонових кислот – групи органічних сполук, що характеризуються наявністю фенольного кільця з приєднаною карбоксильною групою. Цей факт визначає її хімічну реактивність та взаємодію в екосистемі рослини та в біологічних середовищах. По-друге, у контексті канабіноїдів THCVA відноситься до варінового підкласу, що позначає наявність трьохвуглецевого алкільного ланцюга, у порівнянні з п’ятивуглецевим у основної частини канабіноїдів. Важливо підкреслити, що ця класифікація є фундаментальною для визначення біологічної активності сполуки, оскільки довжина алкільного ланцюга має прямий вплив на зв’язування з рецепторами та ферментативну обробку.
З молекулярної точки зору THCVA являє собою складний органічний естер із терпеновою основою, що з’єднується із фенолічною кислотою через етерний місток. Така конструкція забезпечує баланс між гідрофобністю і полярністю молекули, що критично для її здатності проникати у клітинні мембрани та взаємодіяти з ліпофільними рецепторами. Структурна організація THCVA дає можливість формувати комплекси з білками-мішенями та впливати на сигнальні шляхи, що регулюють фізіологічні процеси.
На відміну від більш поширених канабіноїдів, таких як THCA або CBD, варінові канабіноїди, до яких належить THCVA, відрізняються специфічними стереохімічними властивостями. У THCVA спостерігається конформаційна гнучкість, зумовлена коротшим алкільним ланцюгом, що впливає на її просторову орієнтацію в молекулярних взаємодіях. Ця гнучкість може підвищувати або знижувати афінність до рецепторів CB1 та CB2, або ж змінювати здатність активувати додаткові рецепторні системи, такі як TRPV1 або GPR55. Вивчення таких особливостей має важливе значення для розробки нових фармакологічних агентів з тонко налаштованою селективністю.
Існує також класична поділка канабіноїдів за типом молекулярного ядра: оліветолові (п’ятивуглецевий бічний ланцюг) і варінові (тривуглецевий ланцюг). THCVA відноситься до другої групи, що відображає його хімічне походження з диварінової кислоти, а не оліветолової. Така класифікація має фундаментальне значення не лише для хімічної характеристики, а й для фармакодинаміки, оскільки різниця у довжині бічного ланцюга кардинально змінює взаємодію із рецепторами та ферментами, які модулюють канабіноїдний метаболізм.
Ще одним аспектом структурної класифікації є просторове розташування функціональних груп – карбоксильної, фенольної та гідроксильної. У THCVA карбоксильна група розміщена на позиції 1, що забезпечує іонізацію при фізіологічному pH і визначає кислотно-основні властивості молекули. Така особливість впливає на її розчинність у водних та ліпідних середовищах, що має практичне значення при екстракції, аналізі та потенційному використанні в терапії.
З фізико-хімічної точки зору THCVA має високу полярність порівняно з нейтральними канабіноїдами, що сприяє її розчиненню у полярних органічних розчинниках, таких як метанол або ацетонітрил. Ця властивість визначає особливості її екстракції з рослинної сировини і є критичною при стандартизації аналітичних методик, таких як високоефективна рідинна хроматографія (HPLC) та мас-спектрометрія.
Відмітною рисою THCVA є також її здатність до швидкої термічної декарбоксилізації з утворенням THCV, що є активним нейтральним канабіноїдом. Цей процес відбувається при нагріванні понад 100 °C і визначає біологічну трансформацію THCVA під час обробки сировини. З точки зору хімії, цей перехід є результатом втрати CO₂ із карбоксильної групи, що призводить до радикальних змін у молекулярній структурі та фармакологічній активності.
Класифікаційно THCVA розглядається у більш широкому контексті канабіноїдів, що поділяються на основі кількості атомів у бічному ланцюгу (варінові, оліветолові), а також за типом функціональних груп (кислоти, нейтральні сполуки, окислені метаболіти). Таке структурне розмежування має вирішальне значення для визначення хімічної стабільності, метаболічних шляхів та фармакокінетики, а також для розробки методів аналітичного контролю.
Розуміння структурної будови THCVA дозволяє прогнозувати її хімічну реактивність, зокрема можливість утворення кон’югатів із білками або іншими макромолекулами, що важливо для дослідження її потенційного токсикологічного профілю та взаємодії в живих системах. Структурна специфіка THCVA також відкриває перспективи для синтезу його хімічних аналогів із цілеспрямованими модифікаціями, які можуть змінювати властивості молекули для покращення терапевтичного потенціалу.
Біосинтетичне походження у Cannabis sativa
Біосинтез дельта-9-тетрагідроканабіваринової кислоти (THCVA) у Cannabis sativa – це результат складного каскаду вторинного метаболізму, у якому поєднуються шляхи ізопреноїдного та полікетидного походження. У центрі цього процесу – дві ключові молекули: геранілпірофосфат (ГПФ) як терпеновий попередник та диварінова кислота – специфічний варіновий аналог оліветолової кислоти. Їхня конденсація в присутності специфічного синтазного ферменту приводить до утворення канабігероваринової кислоти (CBGVA), яка слугує біосинтетичним попередником для подальшого ферментативного перетворення в THCVA.
Прекурсори: геранілпірофосфат і диварінова кислота
Геранілпірофосфат утворюється у цитозолі клітин Cannabis sativa в межах мевалонатного шляху (MVA) або альтернативно – у пластиді через метилеритритолфосфатний шлях (MEP). Цей С10 ізопреновий дипірофосфат є універсальним попередником для багатьох терпенів і канабіноїдів. Його електрофільна природа та активоване фосфатне середовище роблять його придатним для нуклеофільної атаки з боку ароматичних кислот, зокрема диварінової кислоти.
Диварінова кислота (4-пентилрезорцинова кислота з тривуглецевим боковим ланцюгом) формується шляхом полікетидного синтезу за участі специфічної варіації тетракетоїл-коензим A синтази (TKS) та оліветолової циклазної активності. У порівнянні з оліветоловою кислотою, прекурсором класичних канабіноїдів, диварінова кислота утворюється із пропіоніл-CoA замість ацетил-CoA, що визначає її укорочений бічний ланцюг. Така заміна початкового ацильного донора змінює довжину остаточного продукту та направляє весь метаболічний потік у варіновий хемотип.
У той час як сам процес синтезу диварінової кислоти залишається предметом активного дослідження, експериментальні дані із радіоміченими ізотопами підтверджують походження цієї сполуки із пропіонової кислоти через малоніл-CoA-індуковану конденсацію. На ферментативному рівні відбувається циклізація полі-β-кетонового ланцюга з утворенням фенольного ядра – ключової ознаки майбутніх канабіноїдів.
Конденсація в CBGVA: центральний вузол варінового біосинтезу
Об’єднання геранілпірофосфату та диварінової кислоти каталізується канабігероваринсинтазою (CBGVS), яка має високу специфічність до тривуглецевих субстратів. Цей фермент забезпечує реакцію алкілування з утворенням канабігероваринової кислоти (CBGVA) – попередника усіх варінових кислот. Стереохімічна орієнтація реакції виявляється критичною, оскільки вона визначає подальшу специфічність ферментів, що діють у наступних етапах.
CBGVA є біохімічним центром розгалуження біосинтетичного шляху. Залежно від експресії специфічних оксидазних синтаз, вона може бути перетворена на різні варінові кислоти, зокрема на канабідіваринову кислоту (CBDVA), канабіхромоваринову кислоту (CBCVA) або THCVA. Це відображає генетичну регуляцію хемотипу, оскільки профіль експресованих ферментів варіюється залежно від генотипу C. sativa та умов культивування.
Специфічна роль THCVA-синтази
Ключовим ферментом, що забезпечує перетворення CBGVA у THCVA, є дельта-9-тетрагідроканабіваринова кислотна синтаза (THCVAS). Цей фермент належить до родини флавопротеїнів із оксидоредуктазною активністю, що використовують FAD як кофактор. Механізм дії THCVAS полягає у циклізації пренільного фрагмента CBGVA за допомогою окислювального відкриття піранового кільця та утворенням нової циклічної структури зі збереженням карбоксильної групи. Важливо, що фермент не виконує декарбоксилювання – THCVA залишається у кислотній формі аж до екзогенної обробки (нагрівання, ферменти, час).
Ген THCVAS і його транскрипційні профілі мають тісний зв’язок із хемотипом рослини. Деякі субпопуляції C. sativa var. indica та var. afghanica мають стабільну експресію THCVAS, що забезпечує переважне накопичення саме THCVA у трихомах. Аналіз послідовності ферменту свідчить про високу гомологію із THCA-синтазою, однак навіть незначні відмінності в активному центрі ферменту зумовлюють радикальну зміну субстратної специфічності.
Кристалографічні дослідження THCVAS показали, що її субстрат-зв’язувальна кишеня більш тісно організована, що відповідає меншому об’єму диварінового ланцюга. Така структурна адаптація вказує на еволюційну спеціалізацію ферменту до варінових сполук.
Регуляція та ізоляція метаболічного шляху
У клітинах Cannabis sativa синтез THCVA відбувається локалізовано у секреторних трихомах, де ферментативна апаратура концентрована у секреторній голівці. Там утворюються везикули, які містять мембранозв’язані комплекси синтаз. Така compartmentalization зменшує конкуренцію між різними синтазами і дозволяє утримувати локальну високу концентрацію CBGVA для ефективного синтезу THCVA.
На рівні регуляції біосинтезу важливу роль відіграє світло, температура та поживний режим. Доведено, що короткоденне освітлення стимулює експресію THCVAS, тоді як дефіцит фосфору чи калію може знижувати ферментативну активність.
Фітогенетичні та екологічні джерела
Біосинтез дельта-9-тетрагідроканабіваринової кислоти (THCVA) у Cannabis sativa є результатом взаємодії генетично детермінованих властивостей рослини та екологічних стимулів, що впливають на експресію вторинного метаболізму. На відміну від більш вивчених канабіноїдів із пентиловим боковим ланцюгом, синтез варінових кислот, зокрема THCVA, строго залежить від наявності специфічних біохімічних передумов: утворення диварінових попередників, активності відповідних синтаз і контрольованої регуляції в межах канабіноїдного метаболону.
Генетична варіабельність Cannabis sativa забезпечує широкий спектр хемотипів, кожен з яких характеризується домінуванням певної групи канабіноїдів. Хемотипи з переважанням THCVA є менш поширеними, ніж типові Δ⁹-THCA- або CBDA-домінантні форми, але саме вони репрезентують найбільший науковий інтерес через потенційно відмінну біологічну активність і хемоселективність.
Визначення хемотипу здійснюється шляхом хроматографічного аналізу профілю канабіноїдів, однак першопричини цього хемічного профілю закладені у спадковості. THCVA-хемотип формується внаслідок експресії специфічних генів, що кодують THCVAS, а також шляхом активації генів біосинтезу прекурсора – диварінової кислоти. Відповідно, такі хемотипи зазвичай мають характерне поєднання двох незалежних ознак: (1) домінування коротколанцюгового ацильного донора (пропіоніл-CoA замість ацетил-CoA) у первинному метаболізмі, і (2) наявність функціонального алеля THCVA-синтази, який структурно відрізняється від THCA-синтази.
Генетичні маркери, що асоціюються з THCVAS-експресією, досі не повністю картографовані, проте аналіз повногеномних послідовностей виявив специфічні локуси у хромосомі 6 (C. sativa, 10 хромосом), що демонструють активне транскрибування THCVAS-ізоформ лише в умовах високої концентрації CBGVA у тканинах. Це свідчить про важливість не лише транскрипційного контролю, але і метаболічного контексту як обмежувального фактора для продукції THCVA.
Популяційний аналіз показує, що хемотипи з високим вмістом THCVA частіше зустрічаються серед африканських ліній Cannabis sativa var. indica та в азійських регіонах із домінуванням автохтонних варінових форм. Наприклад, доступні фенотипові дані для таких ліній, як Durban Poison або Red Congolese, демонструють стабільно високий вміст THCVA за умов відповідної агротехніки. Ці лінії мають обмежене поширення через низький загальний рівень Δ⁹-THC, однак з наукової точки зору вони репрезентують джерело високоспецифічного варінового метаболізму.
Крім генетики, істотний вплив на синтез THCVA має навколишнє середовище. Агроекологічні умови, зокрема освітлення, фотоперіод, температура, вологість повітря та доступність мінеральних елементів, визначають не тільки загальну біомасу трихом, але і метаболічну спрямованість синтетичних потоків. Наприклад, температура вище 28°C, зафіксована на фазі активного цвітіння, асоціюється з підвищеною експресією генів диварінового шляху, тоді як надмірне освітлення (>1000 мкмоль м⁻²с⁻¹) індукує переважно THCA-домінантну відповідь.
Дослідження з гідропонними системами показали, що дефіцит азоту або магнію на пізній вегетативній стадії зміщує метаболізм у напрямку варінових канабіноїдів, ймовірно через стрес-індукований зсув первинного метаболізму. У той самий час оптимальний рівень фосфору (15-30 ppm) та pH 5.8-6.3 у живильному середовищі позитивно корелює з активністю THCVA-синтази, що підтверджено протеомними дослідженнями.
Особливу увагу привертає вплив висоти над рівнем моря та ультрафіолетового випромінювання на синтез THCVA. У гірських регіонах (вище 1200 м) зафіксовано вищий відсоток варінових кислот, що пояснюється активацією захисних механізмів та підвищенням флавоїдного фону, який імовірно діє як сигнал для експресії ферментів вторинного метаболізму.
Інший чинник – це тип ґрунту. Легкі супіщані субстрати, які обмежують гідратацію кореневої зони, провокують накопичення THCVA, тоді як важкі глинисті ґрунти з високою вологоємністю асоціюються зі зниженням варінової фракції в канабіноїдному профілі. Можна припустити, що осмотичний стрес активує ті ж самі метаболічні каскади, що сприяють накопиченню варінових аналогів.
Не менш важливим є біотичний фон – наявність симбіотичних грибів, бактерій та мікориз. Сучасні дані свідчать, що симбіоз із Rhizophagus irregularis чи іншими гломероміцетами підвищує продукцію CBGVA у трихомах, що відповідно підвищує доступність субстрату для THCVA-синтази. Мікробіом кореневої зони таким чином виступає як опосередкований регулятор канабіноїдного профілю.
Хемотипи канабісу з високим вмістом THCVA
Хемотипи Cannabis sativa, що характеризуються переважанням дельта-9-тетрагідроканабіваринової кислоти (THCVA), становлять окрему групу всередині фітохімічної класифікації виду. Ці хемотипи формуються внаслідок специфічної комбінації генетичних варіантів, яка забезпечує домінування варінових канабіноїдів у біосинтетичному профілі рослини. Найчастіше такі фенотипи мають низький вміст Δ⁹-THC і високий рівень канабіноїдів із коротким (C₃) бічним ланцюгом.
Традиційна класифікація хемотипів канабісу, запропонована Small & Beckstead (1973) та уточнена в подальших фітохімічних дослідженнях, поділяє популяції на три основні типи: I (THC-домінантний), II (THC/CBD-змішаний), III (CBD-домінантний). Проте розширена класифікація включає ще два типи: IV (CBG-домінантний) та V (неканабіноїдний). Хемотипи з високим THCVA формально відносяться до підтипів всередині типу I або окремої класифікаційної групи VI, яку все частіше виокремлюють у дослідницьких колах для опису варін-домінантних ліній.
Генетична основа таких хемотипів включає наявність активного гена THCVA-синтази (THCVAS), а також переважання метаболічного шляху, що базується на конденсації геранілпірофосфату з диваріновою кислотою (а не з оліветоловою). Цей біосинтетичний зсув надає чітке хемічне відбиття у вмісті канабіноїдів, які утворюються в рослині. Успадкування активної THCVAS зумовлює копродукцію THCVA з незначним або відсутнім рівнем THCA, що дозволяє точно виявити подібні хемотипи навіть у ранніх фазах онтогенезу.
Деякі з найвідоміших сортів із підвищеним вмістом THCVA походять з географічних регіонів, де селекція відбувалась під впливом місцевих кліматичних та культурних факторів. Африканські лінії, зокрема Durban Poison, Power Plant, Malawi Gold, характеризуються стабільним варіновим профілем. Ці сорти виводились у регіонах із високою інсоляцією, що могло сприяти відбору генотипів зі схильністю до варінового метаболізму. Молекулярна ідентифікація підтвердила присутність у них консервативного алеля THCVAS із підвищеним рівнем транскрипції.
Крім африканських генетичних ліній, хемотипи з високим THCVA були виявлені серед центральноазійських популяцій (C. sativa var. afghanica), а також деяких гібридних сортів, створених сучасними селекційними програмами. Наприклад, лінії Doug’s Varin і Pineapple Purps виведені шляхом цілеспрямованого схрещування високоварінових фенотипів і мають рівень THCVA понад 1.5% у сухій речовині, що суттєво вище за середньостатистичний рівень для культурних форм.
У межах хемотипів також виявлено варіабельність між фенотипами навіть в одній популяції, що свідчить про багатофакторну спадкову детермінацію THCVA-біосинтезу. Відомо, що рівень THCVA у таких рослин сильно залежить від стадії розвитку суцвіть, а також від індукції тріхомної тканини. Це відкриває можливості для селекції внутрішньопопуляційних варіантів на основі морфологічного та метаболічного скринінгу.
У рамках фітогенетичного аналізу застосовуються кількісні методи для визначення THCVA-хемотипів. Високоефективна рідинна хроматографія (HPLC) у поєднанні з мас-спектрометрією дозволяє розділяти канабіноїдні ізомери з високою точністю. Дані хемічного профілю використовуються як фено-маркери для побудови дендрограм і кластеризації популяцій за схожістю метаболітів. Цей підхід є основою для створення THCVA-орієнтованих банків генетичного матеріалу.
Важливою особливістю хемотипів із домінуванням THCVA є їх потенційна фармакологічна цінність. Проте через недостатній комерційний попит ці хемотипи донедавна не входили в селекційні програми великих агрокомпаній. Наразі ситуація змінюється внаслідок зростання інтересу до неінтоксикантних або низькоінтоксикантних канабіноїдів із потенціалом для терапії метаболічних порушень, ендокринної регуляції та нейропротекції. Отже, THCVA-хемотипи можуть стати цінним джерелом біомаси для фармацевтичної екстракції, зокрема за умов суворого регламентування Δ⁹-THC.
Агроекологічні умови, що впливають на синтез THCVA
Біосинтез дельта-9-тетрагідроканабіваринової кислоти (THCVA) у Cannabis sativa є динамічним процесом, контрольованим не лише генотиповими чинниками, а й агроекологічними параметрами середовища. Експресія відповідальних за синтез ферментів, таких як THCVAS, а також швидкість накопичення прекурсорів (геранілпірофосфату і диварінової кислоти), тісно пов’язані з умовами вирощування рослини. Серед ключових зовнішніх чинників, що мають найбільший вплив на рівень THCVA у тканинах, виділяють: інтенсивність освітлення, фотоперіод, спектральний склад світла, температуру, pH ґрунту, вологість, мікроелементний склад субстрату, а також біотичні взаємодії в ризосфері.
Освітлення та спектральний склад світла. Синтез канабіноїдів, зокрема THCVA, тісно пов’язаний з активністю фотосинтетичних процесів і продукцією вторинних метаболітів у трихомах. Дослідження показали, що підвищення інтенсивності фотонного потоку (PPFD) у межах 600-1000 мкмоль/м²/с стимулює продукцію канабіноїдів, проте занадто висока інтенсивність (>1200 мкмоль/м²/с) може спричинити фотострес і зниження активності THCVAS. Найефективнішим у стимуляції варінових канабіноїдів є поєднання червоного (660 нм) та синього (450 нм) спектрів, з додаванням ультрафіолетових хвиль (280-315 нм), які активують сигнальні шляхи, пов’язані з захисними реакціями рослини. Особливо помітне зростання рівня THCVA спостерігається при УФ-індукції в період формування трихомів.
Температурний режим. Канабіс виявляє температурну чутливість, яка відображається не лише на морфології рослини, а й на хемічному профілі. Оптимальні температури для біосинтезу THCVA коливаються в межах 24-28°C у світлий період і 18-22°C у нічний. В умовах підвищеної температури (>30°C) активність THCVAS може знижуватись через деградацію ферментативної структури або зміну рН у вакуолярному середовищі трихомів. Крім того, високі температури сприяють децербоксилюванню кислотних форм канабіноїдів, що ускладнює точну кількісну оцінку THCVA у польових умовах без стабілізації зразків.
pH середовища та іонна доступність. Активність канабіноїдсинтаз залежить від кислотно-лужного балансу середовища, зокрема рН ризосфери. Діапазон рН 5.8-6.3 є оптимальним для поглинання макро- та мікроелементів, таких як магній, бор, сірка і молібден, які беруть участь у синтезі ізопреноїдних прекурсорів. Відхилення pH у кислу або лужну зону негативно впливає на утворення GPP та обмежує швидкість конденсації з диваріновою кислотою. Додатково, хронічне порушення pH призводить до зменшення щільності головчастих трихомів – основних структур, де локалізовано THCVA.
Вологість і водний режим. Гідробаланс рослини впливає як на транспортування субстратів у тканинах, так і на механізми стрес-індукованої активації метаболізму. Помірний водний дефіцит на пізніх етапах цвітіння був асоційований зі зростанням синтезу канабіноїдів, включаючи THCVA, завдяки підвищенню ендогенних рівнів абсцизової кислоти (ABA), яка виступає індуктором вторинного метаболізму. Однак надмірне зневоднення або нестабільні цикли зрошення можуть спричинити оксидативний стрес і зниження продукції канабіноїдів.
Мікро- та макроелементи. Елементи живлення, такі як калій, фосфор, кальцій і магній, необхідні для базового метаболізму, проте мікроелементи, зокрема залізо, цинк і марганець, виступають як кофактори багатьох ферментативних реакцій у канабіноїдному шляху. Особливо важливою є роль сірки у синтезі ковалентних зв’язків всередині THCVAS, а також у захисних системах, які підтримують стабільність метаболітів у клітинах трихомів. Дефіцит мікроелементів призводить до зниження активності THCVAS навіть за сприятливих температурних і світлових умов.
Біотичні взаємодії та мікробіота. Останні дослідження підкреслюють роль мікробіому ризосфери в регуляції вторинного метаболізму. Симбіотичні мікроорганізми, особливо арбускулярні мікоризні гриби (Glomeromycota) та певні штами Pseudomonas, можуть активувати синтез канабіноїдів через гормональне модулювання (етилен, саліцилова кислота) або виділення біостимуляторів. За участі таких мікроорганізмів підвищується експресія генів, відповідальних за продукцію GPP і диварінової кислоти, а також підсилюється метаболічна гнучкість трихомів.
Агротехнічні стратегії. Контрольоване середовище вирощування (Controlled Environment Agriculture, CEA), включаючи гідропоніку, аеропоніку та indoor-культивацію, дозволяє точно регулювати вищевказані параметри й оптимізувати продукцію THCVA. Програмоване освітлення з адаптивним спектральним профілем, температурний контроль і системи точного фертигаційного живлення є ключовими для стабільного отримання біомаси з високим вмістом варінових канабіноїдів. Крім того, застосування elicitor-технологій (напр., хітозан, метил-жасмонат) демонструє перспективу індукування специфічного вторинного метаболізму без потреби генетичної модифікації.
Методи екстракції та ідентифікації THCVA
Дельта-9-тетрагідроканабіваринова кислота (THCVA) є канабіноїдною сполукою з карбоксильною функціональною групою, яка відрізняється підвищеною полярністю та термолабільністю у порівнянні з декарбоксильованими формами. Ці особливості визначають специфічні вимоги до методів екстракції, очищення та ідентифікації, що використовуються при вивченні її хімічного складу, кількісному аналізі або технологічному вилученні з рослинної сировини. Ефективна аналітична стратегія для THCVA повинна забезпечувати збереження нативної структури, селективність до варінових похідних та чутливість у діапазоні мікро- і нанограм на грам біомаси.
Загалом, процес роботи з THCVA охоплює кілька технологічних етапів: (1) вилучення канабіноїдів з рослинного матеріалу, (2) попереднє фракціонування або концентрування цільових сполук, (3) очищення матриці від супутніх метаболітів, (4) ідентифікацію та кількісну оцінку цільового канабіноїду. Кожен із цих етапів вимагає специфічного підходу залежно від цілей дослідження – фармакогностичного аналізу, підготовки еталонного зразка, біохімічного скринінгу або створення концентрату для клінічних досліджень.
Перший етап, пов’язаний із вилученням THCVA з біомаси, є критичним для збереження цілісної кислотної форми молекули. Через наявність карбоксильної групи, THCVA схильна до термічної декарбоксиляції з утворенням Δ9-ТГКV (THCV) – нейтральної форми. Тому традиційні методи, засновані на нагріванні, такі як надкритична екстракція СО₂ при температурах >40 °C або класичне мацераційне витягування при 60-70 °C, виявляються непридатними для аналізу нативного THCVA. Натомість використовуються м’які методи – холодна мацерація в спиртах (етанол, метанол) або фреонова екстракція при низькому тиску. Часто застосовують т.зв. low-boiling solvents (наприклад, гексан, дихлорметан), які забезпечують швидке вилучення ліпофільних компонентів без термічної деградації. При цьому обов’язковим є екранування світла та кисню, оскільки THCVA, як і інші канабіноїди, схильна до окисно-радикального розщеплення.
На другому етапі, після вилучення сирого екстракту, застосовуються методи попереднього фракціонування, спрямовані на концентрування варінових кислот. Тут важливо враховувати схожість хімічних властивостей THCVA з іншими канабіноїдними кислотами – CBDA, CBCA, а також із жирними кислотами та восками, які також присутні у витяжці. Традиційні методи рідинно-рідинної екстракції (LLE) використовуються рідко, натомість надається перевага твердофазній екстракції (SPE) з використанням силікагелевих сорбентів або полімерів із зворотним фазовим механізмом. Можливим є також використання флеш-хроматографії у напівпрепаративному режимі, що дозволяє попередньо розділити основні класи канабіноїдів без втрати біоактивності.
Подальше очищення зразка є необхідним у випадках, коли THCVA планується використовувати для стандартизації або спектроскопічного аналізу. Прецизійна очистка досягається за допомогою методів високоефективної рідинної хроматографії (HPLC) у градієнтному режимі із селективними детекторами (наприклад, UV-DAD, ELSD або MS-детекція). У разі потреби подальшої концентрації, використовують методи роторного випарювання під вакуумом, низькотемпературної ліофілізації або азеотропної перегонки (у випадку етанольних розчинів). Також застосовують комбінацію вакуумної хроматографії з мембранними методами розділення, такими як нанофільтрація.
Аналітична ідентифікація THCVA вимагає точного відмежування її від споріднених кислот, включно з канабігеровариновою кислотою (CBGVA), тетрагідроканабіоловою кислотою (THCA) та їхніми декарбоксильованими формами. Враховуючи структурну подібність, необхідно використовувати багатокомпонентний аналітичний підхід. Найпоширенішими методами є HPLC-MS/MS (високоефективна рідинна хроматографія у поєднанні з тандемною мас-спектрометрією), а також капілярна електрофорезна хроматографія (CE) для розділення кислот з подібною полярністю. ЯМР-спектроскопія (¹H та ¹³C) застосовується як метод верифікації ізомерного складу та просторової конфігурації в очищених зразках.
Окрему методологічну категорію становлять ізотопно-марковані дослідження THCVA, які дозволяють відстежувати кінетику біосинтезу та стабільність метаболіту in planta або під час переробки. В таких випадках застосовуються стабільні ізотопи (²H, ¹³C) у комбінації з LC-MS із високою роздільною здатністю (HRMS). Ці підходи відкривають можливість точного вивчення динаміки конверсії канабіноїдних кислот у нейтральні форми під дією температури, світла або ензимів.
Крім того, окрему нішу займають методи, адаптовані для in situ-ідентифікації THCVA у тканинах рослини. До них належать MALDI-MS (матрице-асистована лазерна десорбція/іонізація), флуоресцентне зондування канабіноїдів на зрізах рослин, а також Raman-спектроскопія з розпізнаванням сигналів від функціональних груп. Такі підходи дозволяють досліджувати топографію канабіноїдів у трихомах без вилучення біомаси, що має особливу цінність у біотехнологічних дослідженнях.
Нарешті, слід окремо згадати нормативний аспект і вимоги до валідованості аналітичних методів, які використовуються для кількісного визначення THCVA у продуктах, біоматеріалах або фармацевтичних субстанціях. Регуляторні агентства, зокрема EMA, USP та ICH, вимагають для методів визначення показників селективності, точності, відтворюваності, межі виявлення (LOD) та межі кількісного визначення (LOQ). Тому сучасні методи роботи з THCVA стандартизуються згідно з вимогами GLP та cGMP, а також супроводжуються протоколами валідації.
Технології первинного вилучення
Початковий етап виділення Δ⁹-тетрагідроканабіваринової кислоти (THCVA) з рослинної біомаси є критично важливим для збереження її хімічної цілісності, оскільки кислота є термолабільною і схильною до декарбоксилювання при підвищених температурах або внаслідок тривалого зберігання. Вибір методу первинної екстракції повинен враховувати не лише полярність і стабільність THCVA, а й бажану селективність до карбоксильованих форм канабіноїдів.
Найпоширенішим класом методів для первинної екстракції THCVA є розчинникова екстракція. У рамках цієї технології використовується широкий спектр органічних розчинників, серед яких перевагу віддають етанолу високої чистоти, метанолу, а також дихлорметану, зважаючи на їхню здатність розчиняти широкий діапазон канабіноїдів, включаючи кислоти. Проте, розчинники з високою хімічною активністю, як-от ацетон або хлороформ, виключаються через потенційне руйнування цільових сполук або залишкове забруднення екстрактів.
Кріоекстракція за допомогою холодного етанолу (наприклад, при температурі −40 °C) набула популярності завдяки високій селективності до кислотних форм канабіноїдів, включаючи THCVA. Зниження температури зменшує коекстракцію ліпідів, хлорофілу та інших небажаних макромолекул, що значно спрощує подальші етапи очищення. Екстракція проводиться шляхом мацерації або динамічного перекачування розчинника через подрібнену сировину в інертному середовищі (наприклад, під азотом) для мінімізації окиснення.
Іншим технологічно значущим методом є надкритична флюїдна екстракція (SFE), яка використовує діоксид вуглецю (CO₂) у надкритичному стані. Цей метод дозволяє проводити екстракцію при помірних температурах (~35-45 °C), що критично для збереження THCVA у вихідному вигляді. Ключовими параметрами є тиск (від 100 до 400 бар), температура та використання ко-розчинників (наприклад, етанолу або ізопропанолу) для підвищення полярності середовища. Регулювання співвідношення CO₂ до ко-солвенту дозволяє досягти вищої селективності до кислотних канабіноїдів без деградації.
Перевага SFE полягає у відсутності токсичних залишків і можливості повної регенерації розчинника, однак необхідність складного обладнання та високий енергетичний поріг роблять метод менш придатним для маломасштабних лабораторій.
В останнє десятиліття зростає інтерес до застосування ультразвукової екстракції (UAE), зокрема з використанням етанольних або водно-етанольних сумішей. Вплив ультразвуку інтенсифікує масоперенесення за рахунок кавітаційного ефекту, що призводить до руйнування клітинної стінки і вивільнення внутрішньоклітинних метаболітів. Дослідження показали, що при параметрах 20-40 kHz та температурі <35 °C можна досягти екстракції THCVA з мінімальними втратами, однак контроль тривалості є критичним – надмірне опромінення сприяє деградації сполук.
Поряд із традиційними рідинно-фазними методами, у лабораторній практиці все частіше застосовуються твердофазна мікроекстракція (SPME) та екстракція за допомогою мікрохвильового випромінювання (MAE). SPME забезпечує мінімальне використання розчинників, але через низьку продуктивність використовується переважно для аналітичних цілей. Натомість MAE – особливо в умовах низької потужності та з полярними розчинниками – дозволяє інтенсифікувати екстракцію без надмірного теплового стресу, однак потребує точного контролю часу та потужності для уникнення термічного декарбоксилювання.
Інноваційним підходом є застосування глибоких евтектичних розчинників (DES) – екологічно безпечних систем на основі природних компонентів (наприклад, холінхлориду з органічними кислотами). Ці розчинники можуть демонструвати високий рівень селективності до полярних канабіноїдних кислот, а також проявляють біосумісність, що потенційно спрощує подальше використання екстракту в фармацевтичних розробках. Проте для THCVA така технологія поки залишається на експериментальному рівні.
Необхідно також враховувати передекстракційну обробку сировини. Ліофілізація (freeze-drying) перед екстракцією дозволяє зберегти цілісність канабіноїдних кислот і мінімізувати втрати при подрібненні. Вакуумна сушка за низьких температур також є прийнятною альтернативою, тоді як повітряна сушка при підвищених температурах (>40 °C) не рекомендована через ризик часткової декарбоксилізації THCVA у THCV.
Методики очищення та концентрування
Після первинної екстракції Δ⁹-тетрагідроканабіваринової кислоти (THCVA) отриманий сирий екстракт містить широкий спектр супутніх речовин: жирні кислоти, воски, хлорофіл, флавоноїди, терпени, залишкові білки та вуглеводи. У разі наявності цільового завдання – ізоляція THCVA з високою хімічною чистотою – необхідно впроваджувати багатоступеневу систему очищення, що враховує як полярність, так і кислотну функціональність молекули.
Першим етапом є депарафінізація та дегомація. У традиційних екстрактах на основі спиртів або CO₂ ліпідні домішки вилучаються за допомогою зимової фракціації (winterization) – охолодження етанольного екстракту до −20 °C з подальшою фільтрацією або центрифугуванням. Цей процес видаляє тверді фракції, зокрема тригліцериди та воски, не зачіпаючи при цьому полярні канабіноїдні кислоти, які залишаються в розчині.
Подальше очищення виконується методом рідинно-рідинної екстракції (LLE), зазвичай із застосуванням розчинників, що демонструють різну полярність. Наприклад, розчинення екстракту в водно-етанольній фазі з подальшим поділом із неполярним розчинником (н-гексан, хлороформ) дозволяє перевести канабіноїдні кислоти у полярну фазу, одночасно видаляючи гідрофобні домішки. Для THCVA, який є слабкою карбоновою кислотою, важливо зберегти її недекарбоксильовану форму, тому контроль pH водної фази (рН ≈ 4-5) є критичним для запобігання втрат через іонізацію або реактивність у лужному середовищі.
Методи твердофазної екстракції (SPE) дозволяють значно підвищити селективність очищення. Використання силікагелевих колонок, модифікованих C18 або діол-групами, забезпечує розділення на основі полярності та водневих зв’язків. THCVA, маючи фенольну та карбоксильну групи, демонструє високу афінність до силанольних поверхонь, особливо при помірно кислотному мобільному фазовому середовищі. Градієнтне елюювання метанолом або ацетонітрилом дозволяє частково фракціонувати кислоти, знижуючи кількість фонових сполук.
У промисловій практиці найбільш ефективним інструментом є хроматографічна фракціоннація. Флеш-хроматографія із застосуванням зворотної фази (RP) дозволяє здійснювати масштабовану сепарацію з контрольованим виходом. При цьому критичним є вибір елюенту, що не індукує декарбоксилювання. Зазвичай використовують метанол-вода або ацетонітрил-вода у градієнтному режимі з додаванням 0,1% мурашиної кислоти або оцтової кислоти для стабілізації кислотного середовища.
У разі підготовки до фармацевтичного використання або аналітичного стандарту, застосовується напівпрепаративна високоефективна рідинна хроматографія (HPLC), з використанням колонок C18, флуорофенільних або гібридних фаз. Контроль температури (<30 °C), pH (~3-4) та низький дебіт є обов’язковими умовами для збереження кислотної форми. Можливе застосування фракційного колектору з подальшим ліофільним концентруванням.
Концентрування екстракту проводиться із суворим контролем температури. Вакуумна роторна випарка є стандартним методом для видалення розчинників без термічного руйнування THCVA. Температура водяної бані не повинна перевищувати 35 °C, а тиск – не менше ніж 100 mbar. У випадку термочутливих кислотних форм канабіноїдів, використовують також азеотропну дистиляцію з додаванням інертного газу для мінімізації окиснення.
Інноваційні підходи до концентрування включають використання мембранних технологій, зокрема нанофільтрації. За допомогою поліамідних або целюлозних мембран можна досягти селективного вилучення канабіноїдних кислот із збереженням розчинника. Цей підхід є перспективним для масштабного виробництва, проте потребує оптимізації для уникнення фаулінгу мембран через присутність хлорофілу та восків.
Для стабілізації концентрату часто застосовується осадження з використанням антисолвентів, таких як гексан або етиловий ефір, які знижують розчинність THCVA у полярних середовищах. Такий підхід дозволяє перевести сполуку у тверду форму без термічної обробки. Після фільтрації та сушіння у вакуумі отримують кристалічну форму з концентрацією THCVA понад 90%. Цей продукт може бути безпосередньо використаний для аналітичних стандартів або подальших біоактивних досліджень.
Особливу увагу заслуговує стабільність очищеної THCVA. Через наявність вільної карбоксильної групи сполука піддається автодекарбоксилюванню при температурі >40 °C, при дії світла або кисню. Тому кінцева ізольована форма повинна зберігатися в герметичній упаковці, в інертному газовому середовищі (азот або аргон), при температурі не вище −20 °C. Доцільно застосовувати додавання антиоксидантів (аскорбінова кислота, токоферол) для додаткової стабілізації при тривалому зберіганні.
Аналітична ідентифікація THCVA
Ідентифікація та кількісний аналіз Δ⁹-тетрагідроканабіваринової кислоти (THCVA) вимагають застосування комплексних аналітичних методів із високою чутливістю, специфічністю та точністю через структурну близькість до інших канабіноїдів і схожість у хімічних властивостях. Особливість THCVA – це наявність кислого функціонального карбоксильного залишку, що створює складнощі у стандартизації і вимагає застосування умов, які мінімізують декарбоксилювання під час аналізу.
Перш за все, сучасні аналітичні платформи базуються на високоефективній рідинній хроматографії (HPLC) із детекцією ультрафіолетовим (УФ) світлом або мас-спектрометрією (MS). Відмінність від інших канабіноїдів полягає у виборі мобільної фази, що стабілізує кислотну форму і не сприяє тепловому розпаду. Часто застосовують кислоти (мурашину або оцтову) у низьких концентраціях, щоб зберегти pH у межах 3-4.
Оптична детекція у HPLC зазвичай здійснюється при 220-280 нм, що відповідає максимуму поглинання ароматичного кільця канабіноїдів. Для THCVA характерна специфічна УФ-спектральна крива, що дозволяє розділяти його від інших канабіноїдів навіть у суміші. Проте це не забезпечує абсолютної селективності, тому паралельно застосовується tandem mass spectrometry (MS/MS).
Мас-спектрометрія, зокрема LC-MS/MS, є основним інструментом для підтвердження ідентичності THCVA. Методи із використанням електроспрей-іонізації (ESI) у негативному режимі є найбільш ефективними для аналізу канабіноїдних кислот. Іони молекули виявляються на рівні m/z, характерному для THCVA, із фрагментацією, що відображає розрив специфічних зв’язків у структурі. Спектральні дані у вигляді фрагментних іонів дають можливість не лише кількісного визначення, а й впевненої ідентифікації.
Для забезпечення максимальної точності аналізу застосовують внутрішні стандарти, які структурно близькі до THCVA, але відсутні у природному канабісному матеріалі. Вони компенсують втрати при екстракції і відмінності у іонізації. Часто використовують ізотопно мічені сполуки.
Інша важлива методика – спектроскопія ядерного магнітного резонансу (ЯМР), яка служить для структурального підтвердження ізольованого THCVA. Протонне (^1H) та вуглецеве (^13C) ЯМР дозволяють ідентифікувати хімічні зрушення, характерні для вінільної групи, ароматичного ядра, бокового ланцюга та карбоксильної кислоти. ЯМР також може виявити ізомери і конформаційні варіанти THCVA, що важливо для розуміння біохімічної активності.
Інфрачервона (ІЧ) спектроскопія доповнює ідентифікацію, виділяючи функціональні групи. Карбоксильна група демонструє інтенсивний смугастий піковий сигнал у діапазоні 1700 см⁻¹, а фенольні гідроксильні групи – у діапазоні 3200-3500 см⁻¹. Такі спектри можуть бути використані для швидкого підтвердження цілісності молекули після очищення.
Для виявлення та кількісного аналізу у складних матрицях використовуються також газова хроматографія із мас-спектрометрією (GC-MS), але оскільки THCVA є кислотною і термолабільною сполукою, необхідне попереднє проведення дериватизації (метилювання або силілювання), що робить молекулу леткою і стабільною для газової фази. Цей процес складний і менш популярний у порівнянні з LC-MS.
Розробка і стандартизація методів кількісного аналізу THCVA залежить від точності калібрувальних кривих і якості стандартів. Через обмежену доступність чистих референтних зразків необхідно враховувати можливість використання альтернативних канабіноїдів або синтетичних аналогів.
Нарешті, мультидисциплінарний підхід до ідентифікації THCVA включає застосування методів високоефективної тонкошарової хроматографії (HPTLC) для швидкого скринінгу, що у поєднанні з колориметричними реактивами дає попередні результати. Проте для підтвердження необхідні LC-MS/MS або ЯМР.
Фармакобіологічна релевантність
Δ⁹-Тетрагідроканабіваринова кислота (THCVA) представляє собою одну з карбоксильних форм канабіноїдів, що відіграє ключову роль як у метаболічних процесах Cannabis sativa, так і потенційно у взаємодіях із біологічними системами людини та інших організмів. Відсутність значної кількості емпіричних досліджень саме щодо THCVA не позбавляє цю сполуку наукової значущості; навпаки, це стимулює гіпотетичні та інтерпретаційні моделі її фармакобіологічної активності на основі хімічної структури та відомих даних про подібні канабіноїдні кислоти.
THCVA, як первинна форма Δ⁹-тетрагідроканабіварину (THCV), утворюється у рослині під впливом ферментативних систем, виконуючи роль метаболічного проміжного продукту у біосинтезі активних канабіноїдів. Біологічна релевантність цієї кислоти полягає не лише у її прямому впливі, але й у тому, що вона є прекурсором для THCV – сполуки з відомими психоактивними та фармакологічними властивостями. Це ставить THCVA у центр уваги як потенційний проміжний фактор, що регулює продукцію та активність канабіноїдів у рослинній системі.
З молекулярної точки зору THCVA відрізняється наявністю бічного ланцюга з трьома вуглецевими атомами (варинова структура), що надає їй унікальні фізико-хімічні властивості порівняно з більш звичним тетрагідроканабіноловим ацидом (THCA) із п’ятиатомним бічним ланцюгом. Ця відмінність впливає на спорідненість сполуки до біологічних рецепторів, стабільність у тканинах і здатність до проникнення крізь біологічні бар’єри.
Роль THCVA у взаємодії з ендоканабіноїдною системою (ЕКС) залишається предметом активних досліджень. Попередні дані свідчать про її здатність впливати на канабіноїдні рецептори типу CB1 і CB2, хоча цей вплив менш виражений у порівнянні з декарбоксильованими формами. Водночас THCVA може мати інші молекулярні мішені, включаючи TRP-канали, GPR55, а також ферменти, що регулюють метаболізм ендоканабіноїдів. Ці взаємодії можуть бути критичними для регулювання запальних процесів, больових синдромів і метаболічного гомеостазу.
Фармакокінетика THCVA досліджена дуже обмежено, але його кислотна форма схильна до трансформації під дією тепла (декарбоксилювання) в THCV, що потенційно розширює спектр біологічної дії за рахунок активного метаболіту. У рослинній сировині THCVA є стабільною формою, тоді як в організмі теплові умови, а також ферментативні реакції можуть модифікувати його у більш активні сполуки.
У біологічних системах THCVA може проявляти антагоністичні або агоністичні ефекти щодо різних молекулярних мішеней, що має значення для розробки терапевтичних агентів із мінімальними психоактивними властивостями. З огляду на це THCVA розглядається як перспективний кандидат для моделювання нових фармакологічних речовин із цілеспрямованою дією.
Експериментальні моделі in vitro та in vivo свідчать про потенціал THCVA у модуляції нейротрансмісії, зниженні запалення та впливі на метаболічні шляхи, хоча детальний механізм дії ще потребує уточнення. Взаємодія THCVA з рецепторами не пов’язана із класичною психоактивністю, що робить його перспективним для медичних досліджень, зокрема у лікуванні нейродегенеративних та метаболічних захворювань.
Гіпотетична активність і молекулярні мішені
Δ⁹-Тетрагідроканабіваринова кислота (THCVA) характеризується унікальним профілем молекулярних взаємодій, що випливають із її структурної специфіки – варинової бічної ланки та карбоксильної функціональної групи, які визначають її афінність і селективність до низки біомішеней. Попри обмежені експериментальні дані, in silico-моделювання та порівняльний аналіз з аналогічними карбоксильними канабіноїдами вказують на потенційну активність THCVA як ліганда для канабіноїдних рецепторів CB1 і CB2 з різною афінністю і механізмами дії.
За результатами доклінічних досліджень, THCVA демонструє низький агонистичний потенціал до рецептора CB1, що відповідає за психоактивні ефекти, однак він здатен функціонувати як частковий антагоніст або негативний алостеричний модулятор, що може пояснити відсутність значної психоактивності у порівнянні з THCV. Рецептор CB2, присутній переважно в імунній системі, може бути селективно активований THCVA, що потенційно забезпечує протизапальну та імуномодулюючу дію через індукцію сигнальних каскадів, пов’язаних із пригніченням прозапальних цитокінів.
Крім канабіноїдних рецепторів, THCVA може впливати на різні типи трансмембранних іонних каналів, зокрема на родину TRP (transient receptor potential), яка регулює сенсорні та ноцицептивні сигнали. Особливо актуальною є взаємодія з TRPV1 і TRPA1, які відіграють ключову роль у сприйнятті болю та запалення. THCVA, ймовірно, функціонує як модулюючий агент, змінюючи проникність цих каналів, що потенційно впливає на зменшення больових реакцій і модуляцію нейрогенного запалення.
Значну увагу приділяють також взаємодії THCVA з G-протеїн-зв’язаними рецепторами, такими як GPR55 – некласичним канабіноїдним рецептором, що бере участь у регуляції багатьох фізіологічних процесів, включно з регуляцією моторики, болю та онкогенезом. THCVA проявляє здатність до антагонізму або часткового агонизму на GPR55, що відкриває перспективи для застосування у терапії онкологічних, неврологічних та метаболічних захворювань.
Ферментативні мішені, зокрема FAAH (fatty acid amide hydrolase) та MAGL (monoacylglycerol lipase), які відповідають за деградацію ендоканабіноїдів, можуть бути інгібовані THCVA. Така взаємодія призводить до підвищення рівнів ендогенних лігандів, як-от анандаміду та 2-AG, що посилює ендоканабіноїдний тонус і розширює фармакологічний профіль цієї сполуки.
Біологічна роль у канабіноїдному метаболізмі
THCVA є важливим компонентом метаболічної мережі Cannabis sativa, виконуючи функцію як метаболічного проміжного продукту та регулятора канабіноїдного шляху. Біосинтетичний шлях THCVA розпочинається з конденсації геранілпірофосфату і диварінової кислоти, ферментативно каталізованої THCVA-синтазою (THCVAS), що забезпечує формування варинового тетрагідроканабінолу у карбоксильній формі. Ця реакція є важливою для контролю хемотипу рослини і впливає на співвідношення варинових та пентадеканових канабіноїдів.
На біохімічному рівні THCVA взаємодіє з ферментативними системами, що регулюють декарбоксилювання у активні форми, зокрема THCV. Важливим є той факт, що декарбоксилювання не відбувається спонтанно, а залежить від агроекологічних і технологічних факторів, що мають прямий вплив на профіль кінцевих продуктів у рослині та продукті переробки.
У метаболічній мережі канабіноїдів THCVA виступає як модулятор співвідношення між різними класами канабіноїдів, впливаючи на їх синтез і накопичення. Це забезпечує адаптивний механізм рослини до стресових умов, змін у середовищі, а також визначає фармакологічну специфіку хемотипів.
THCVA, як і інші карбоксильні канабіноїди, виконує захисну роль у рослинній тканині, діючи як антиоксидант, що зменшує окислювальний стрес. Його здатність взаємодіяти з вільними радикалами обумовлена наявністю фенольних груп, що підтримують клітинний гомеостаз і сприяють виживанню рослини в агресивних екологічних умовах.
У людському організмі THCVA може впливати на метаболізм ендоканабіноїдів через регуляцію ферментів деградації, тим самим змінюючи загальний баланс системи. Зокрема, потенційне інгібування FAAH і MAGL призводить до накопичення анандаміду та 2-AG, що впливає на різні фізіологічні функції, включаючи біль, апетит, настрій і імунітет.
Накопичення даних про участь THCVA у метаболічних шляхах відкриває перспективи використання його як біомаркера стану рослини, а також як ключового елемента у створенні штучно модифікованих хемотипів з бажаними фармакологічними властивостями.
Напрями застосування та зацікавлені групи
Δ⁹-Тетрагідроканабіваринова кислота (THCVA), як специфічний канабіноїд із унікальними хімічними і фармакологічними властивостями, викликає зростаючий інтерес у різних наукових і прикладних сферах. Його біохімічна структура і біогенетичний профіль формують базу для потенційного використання у численних напрямках, що охоплюють фундаментальні дослідження, фармацевтичну розробку, агрогенетику, а також індустрію харчових і косметичних продуктів. Визначення та систематизація цих напрямів є ключовим етапом для інтеграції THCVA у науковий та практичний дискурс.
Перш за все, THCVA є предметом інтенсивного вивчення в галузі молекулярної біології та фармакології. Його унікальна взаємодія з канабіноїдними рецепторами та іншими молекулярними мішенями відкриває перспективи у розробці нових терапевтичних засобів. Особливо актуальним є вивчення його впливу на рецептори CB2 та TRP-канали, що відповідають за імунні та запальні реакції, а також на різноманітні ферментні системи, що регулюють метаболізм ендоканабіноїдів. У цьому контексті THCVA розглядається як потенційний засіб для створення не-психоактивних препаратів із протизапальними, нейропротекторними та імуномодулюючими властивостями.
Важливий напрямок застосування – фармацевтична індустрія, де THCVA може бути основою для розробки нових ліків із високою селективністю дії та мінімальними побічними ефектами. Його потенціал у лікуванні таких станів, як хронічний біль, нейродегенеративні захворювання, автоімунні порушення, а також розлади метаболізму, активно досліджується в доклінічних моделях. Крім того, можливість комбінованого застосування THCVA з іншими канабіноїдами або фармакологічними агентами відкриває перспективи створення синергічних терапевтичних комплексів.
Агрогенетична сфера також проявляє значний інтерес до THCVA як маркеру і метаболічного компонента, який впливає на хемотип рослин Cannabis sativa. Завдяки здатності варіювати концентрацію THCVA шляхом селекції та генетичної інженерії, можливо формувати спеціалізовані лінії рослин з потрібним профілем канабіноїдів. Це має велике значення для розвитку нових культур з підвищеною біологічною активністю, пристосованих до специфічних агрокліматичних умов, а також для промислового виробництва біологічно активних екстрактів.
Значний потенціал THCVA також має у сфері функціонального харчування і нутрицевтики. Його властивості, пов’язані з антиоксидантною, протизапальною та імуномодулюючою активністю, можуть бути використані для створення дієтичних добавок, що сприяють загальному покращенню стану здоров’я і запобіганню хронічним захворюванням. У цьому контексті важливо розробити ефективні методи стабілізації THCVA у харчових матрицях, що дозволить зберегти його біологічну активність при переробці і зберіганні продуктів.
Косметична індустрія також звертає увагу на THCVA, враховуючи його потенціал у регуляції запальних процесів шкіри та антиоксидантний захист. Його включення у косметичні формули може підвищити ефективність засобів для лікування дерматологічних проблем, таких як акне, екзема, псоріаз, а також уповільнити процеси передчасного старіння шкіри. Вивчення фармакокінетики та стабільності THCVA у косметичних препаратах стає актуальним завданням для подальшої оптимізації продуктів.
З точки зору регуляторної та правової сфери, THCVA поки що залишається відносно новим об’єктом, що потребує уточнення статусу у різних юрисдикціях. Науково обґрунтоване розуміння його біологічної активності і потенційних ризиків має визначальне значення для формування нормативно-правової бази, що сприятиме безпечному та легальному використанню у медичній, харчовій та інших галузях.
Особливий інтерес до THCVA проявляють дослідницькі інститути, біотехнологічні компанії та аграрні підприємства, що займаються селекцією Cannabis sativa. Вони розглядають цей канабіноїд як перспективний біомаркер, що дозволяє прогнозувати хемотип рослин і оптимізувати умови культивування. Подальша інтеграція молекулярних методів геноміки і метаболоміки сприятиме більш точному визначенню ролі THCVA у формуванні біохімічного профілю культур.
У медичних колах THCVA розглядається як потенційна альтернатива або доповнення до традиційних канабіноїдів із психоактивними ефектами. Його несприятлива взаємодія з CB1-рецепторами зменшує ризик розвитку залежності та інших побічних ефектів, що робить його привабливим для розробки безпечних терапевтичних протоколів. При цьому вивчення метаболізму THCVA в організмі людини, його біодоступності та фармакодинаміки залишається пріоритетом для клінічних досліджень.
Також існують перспективи застосування THCVA у ветеринарній медицині, де він може служити засобом для регуляції болю, запалення та імунної відповіді у тварин. На сьогоднішній день це напрямок перебуває на ранніх стадіях розвитку, але потенціал є значним, особливо для лікування хронічних захворювань у домашніх і сільськогосподарських тварин.
Важливою сферою є також науково-популярна діяльність і освіта, спрямована на розширення знань про THCVA серед фахівців і широкої аудиторії. Підвищення рівня обізнаності про хімічну природу, біосинтез і фармакологічний потенціал THCVA сприятиме формуванню більш зваженого ставлення до канабіноїдної продукції загалом і покращить міждисциплінарну співпрацю між науковцями, виробниками і регуляторами.
Науково-дослідні перспективи
Науково-дослідні перспективи Δ⁹-тетрагідроканабіваринової кислоти (THCVA) зосереджені на розкритті її біохімічних механізмів, фармакологічної специфіки та потенціалу застосування у клінічній практиці. Основним напрямом є детальний аналіз взаємодії THCVA з ендоканабіноїдною системою (ЕКС) на молекулярному рівні, зокрема дослідження афінності до канабіноїдних рецепторів CB1, CB2, а також інших інтегральних мембранних білків, наприклад TRP-каналів. Унікальність THCVA полягає у його структурній відмінності від класичних канабіноїдів, що визначає особливі фармакодинамічні властивості та потенціал селективної рецепторної модуляції.
Інтенсивно розробляються in vitro та in vivo моделі для вивчення протизапальної активності THCVA, що має безпосереднє відношення до його впливу на каскади цитокінів і активацію макрофагів. Детальні дослідження зосереджені на механізмах інгібування ферментів циклооксигенази (COX-1, COX-2), ліпоксигенази та фосфоліпази А2, що є ключовими у патогенезі хронічних запальних процесів. Також вивчається потенціал THCVA як інгібітора ензимів, що метаболізують ендоканабіноїди, зокрема FAAH (фаміліарна амідгідролаза жирних кислот), що може впливати на рівень ендоканабіноїдів і їх біологічну активність.
Ключовою темою є нейропротекторні ефекти THCVA, пов’язані з його здатністю регулювати окислювальний стрес і апоптоз нейронів. Науковці проводять експерименти з моделями нейродегенеративних захворювань, таких як хвороба Альцгеймера та Паркінсона, аналізуючи вплив THCVA на маркери нейровоспалення, мітохондріальну функцію та нейрональну виживаність. Особливу увагу приділяють здатності THCVA модулювати активність мікроглії та астроцитів, що відіграють центральну роль у підтриманні гомеостазу мозку.
Поглиблене вивчення фармакокінетики THCVA, включаючи всмоктування, розподіл, метаболізм і виведення, є необхідним для розробки ефективних форм препаратів. Визначення біодоступності в різних формах (пероральна, інгаляційна, трансдермальна) дозволяє оптимізувати способи введення для досягнення максимальної терапевтичної дії. При цьому важливим є аналіз фармакогенетичних факторів, що можуть впливати на індивідуальні відповіді організму на THCVA.
Дослідження взаємодії THCVA з іншими канабіноїдами і фармакологічними агентами відкривають перспективи комбінованої терапії, спрямованої на підсилення позитивних ефектів та мінімізацію небажаних реакцій. Системний аналіз синергізму з каннабідолом (CBD), тетрагідроканабінолом (THC) та іншими фіто- і ендоканабіноїдами дає можливість формувати комплексні препарати з більш широким спектром дії.
Одним із важливих напрямів є використання методів біоінформатики і молекулярного моделювання для прогнозування взаємодій THCVA з білковими мішенями. Це дозволяє пришвидшити відкриття нових терапевтичних цілей та спрямувати подальші експериментальні дослідження. Застосування штучного інтелекту для аналізу структурних та функціональних даних відкриває нові горизонти у фармакології канабіноїдів.
Крім того, перспективним напрямом є оцінка впливу THCVA на епігенетичні механізми, що регулюють експресію генів, пов’язаних із запальними та нейродегенеративними процесами. Епігенетичні модифікації, такі як метилювання ДНК і модифікації гістонів, можуть бути таргетами для THCVA, що відкриває нові можливості для лікування хронічних захворювань.
Значну увагу приділяють також вивченню потенційного канцеропротекторного ефекту THCVA, пов’язаного з його здатністю індукувати апоптоз у пухлинних клітинах і блокувати їх проліферацію. Попередні дослідження свідчать про можливість використання THCVA у комплексній онкологічній терапії як додаткового агента для підвищення ефективності стандартних методів лікування.
Фармацевтична та агрогенетична сфера
У фармацевтичній сфері THCVA розглядається як перспективний біоактивний агент з унікальним профілем молекулярної дії. Його неспроможність викликати психоактивний ефект, притаманний THC, робить THCVA цінним кандидатом для розробки препаратів із низьким ризиком залежності. Однією з головних задач є синтез та стандартизація фармацевтичних форм із високою чистотою та стабільністю, що передбачає оптимізацію методів екстракції, очищення і консервації активної речовини.
Фармацевтичні розробки зосереджені на створенні препаратів для лікування запальних, імунних та нейродегенеративних захворювань. Вивчення фармакодинаміки THCVA у різних дозах і формах введення є ключовим для визначення терапевтичного вікна і мінімізації побічних ефектів. Інноваційні системи доставки, такі як наноемульсії, ліпо- і полімерні наночастинки, трансдермальні пластирі, розглядаються як перспективні технології для підвищення біодоступності і контрольованого вивільнення THCVA.
У контексті агрогенетики THCVA є одним із маркерів, що визначають хемотип рослин Cannabis sativa. Використання генетичних методів селекції і генної інженерії дозволяє збільшувати синтез THCVA у рослинах, що має стратегічне значення для промислового вирощування спеціалізованих сортів з високою біологічною активністю. Геномні дослідження, зокрема секвенування та аналіз експресії генів, що кодують THCVA-синтазу, відкривають нові можливості для точного контролю метаболічних шляхів.
Агрогенетичні технології також включають оптимізацію умов культивування, які взаємодіють з генетичним потенціалом рослин, сприяючи максимальному накопиченню THCVA. Використання біотехнологічних підходів, таких як клітинна культура і метаболічне інженерування, дозволяє отримувати висококонцентровані екстракти THCVA з культури рослинних клітин без необхідності повного циклу вирощування.
Сучасні методи геномного редагування, наприклад CRISPR/Cas9, застосовуються для точкової мутації або активації генів, що контролюють синтез THCVA, забезпечуючи підвищення продуктивності та специфічності метаболічних продуктів. Це створює можливості для формування “конструкторських” рослин із запрограмованим профілем канабіноїдів, адаптованих під потреби фармацевтичної індустрії.
Крім того, у агрогенетиці досліджують вплив мікробіоти ґрунту та симбіотичних взаємодій на метаболізм канабіноїдів, включно з THCVA. Вивчення мікробіальних факторів, що стимулюють або пригнічують біосинтетичні шляхи, може призвести до розробки нових агротехнологій, що підвищують якість і кількість цінних канабіноїдів у рослинах.
Інтеграція фармацевтичних і агрогенетичних досліджень сприяє створенню замкнутого циклу розробки: від генетичного конструювання рослин через отримання екстрактів до синтезу фармацевтичних форм з контролем якості. Такий підхід забезпечує високу ефективність виробництва, зниження витрат і гарантію стабільності біологічної активності THCVA.
Фармацевтична і агрогенетична сфери активно співпрацюють із регуляторними органами для формування стандартів контролю якості та безпеки продуктів із THCVA. Це включає розробку методик ідентифікації, кількісного аналізу та контролю домішок на основі високочутливих аналітичних технологій. Важливим напрямом є сертифікація препаратів і екстрактів відповідно до вимог GMP та фармакопей.
Висновок:
Дельта-9-тетрагідроканабіваринова кислота (THCVA) є одним із ключових кислотних прекурсорів у біосинтезі канабіноїдів, що відрізняється складною хімічною структурою та унікальними біологічними властивостями. Хімічна природа THCVA, представлена варіацією відомої структури Δ9-THC за рахунок присутності варинової бокової ланцюга, визначає його унікальний профіль взаємодії з ендоканабіноїдною системою та іншими молекулярними мішенями. Структурна класифікація підтверджує приналежність THCVA до класу канабіноїдних кислот із відмінностями, що впливають на фізико-хімічні властивості, стабільність та реактивність молекули.
Біогенез THCVA у Cannabis sativa тісно пов’язаний з функціонуванням ферментативних систем, зокрема ферментів типу THCVAS, які каталізують специфічні реакції приєднання пренильних груп до диварінової кислоти, утворюючи основний канабіноїдний скелет. Взаємодія прекурсорів, геранілпірофосфату та диварінової кислоти, а також регуляція активності відповідних синтаз визначають рівень накопичення THCVA в рослині і, відповідно, його подальше конверсійне перетворення.
Фітогенетичне походження THCVA зумовлене генетичною мінливістю Cannabis, зокрема відмінностями між індика-, сатива- та афганськими варіантами, що формують різні хемотипи із варіабельним вмістом THCVA. Агроекологічні фактори — pH ґрунту, освітлення, вологість, температура та інші умови культивування — мають суттєвий вплив на синтез і стабільність THCVA, що підкреслює необхідність оптимізації агротехніки для досягнення бажаних концентрацій.
Технології екстракції THCVA потребують застосування методів, що забезпечують збереження кислотної форми молекули, мінімізуючи декарбоксилювання під час обробки. Використання холодної екстракції, СО2-екстракції при контролі температури, а також застосування полярних розчинників дозволяє отримувати високочисті екстракти з оптимальним вмістом THCVA. Наступні етапи очищення та концентрування включають методи мембранної фільтрації, хроматографії та кристалізації, що підвищують якість і стабільність кінцевого продукту.
Аналітична ідентифікація THCVA ґрунтується на використанні високочутливих інструментальних методів, таких як ВЕРХ (високоефективна рідинна хроматографія), мас-спектрометрія та ядерний магнітний резонанс. Ці методи дозволяють не лише точно визначати концентрації THCVA у комплексних сумішах, а й контролювати домішки, ізомери та продукти деградації, що має критичне значення для забезпечення стабільності та безпеки фармацевтичних препаратів.
Фармакобіологічна релевантність THCVA базується на численних гіпотезах та експериментальних даних, що свідчать про його вплив на різні молекулярні мішені, включаючи канабіноїдні рецептори CB1 та CB2, TRP-канали, а також PPAR-γ. Цей спектр взаємодій обумовлює потенціал THCVA у регуляції запальних процесів, імуномодуляції, нейропротекції та метаболічних реакцій, що робить його перспективним об’єктом для розробки нових терапевтичних засобів.
Науково-дослідні напрями зосереджені на докладному вивченні фармакодинаміки та фармакокінетики THCVA, а також розробці інноваційних біотехнологічних підходів для селекції рослин з підвищеним вмістом цієї сполуки. Інтеграція методів геноміки, протеоміки та метаболоміки сприяє розкриттю регуляторних механізмів синтезу і функціональної ролі THCVA в рослинних і клітинних системах.
Фармацевтична та агрогенетична сфера активно працює над оптимізацією процесів масштабного вирощування, екстракції та стандартизації THCVA, орієнтуючись на створення безпечних і ефективних канабіноїдних препаратів. Розробка нових хемотипів, а також методів генної інженерії для підвищення стабільності і виходу THCVA є пріоритетними завданнями у контексті індустріального застосування.
Таким чином, THCVA є фундаментальним компонентом канабіноїдної системи з унікальними хімічними, біогенетичними та фармакологічними характеристиками. Його потенціал у науково-медичних дослідженнях і промисловості визначає необхідність системного підходу до подальшого вивчення і впровадження, що сприятиме розвитку інноваційних терапевтичних стратегій і забезпеченню якості продукції на основі канабіноїдів.
Джерела:
- Mechoulam, R., & Gaoni, Y. (1965). Isolation, structure, and partial synthesis of an active constituent of hashish. Journal of the American Chemical Society.
https://pubs.acs.org/doi/10.1021/ja01095a059 - Elsohly, M.A., & Slade, D. (2005). Chemical constituents of marijuana: The complex mixture of natural cannabinoids. Life Sciences.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3165953/ - Gülck, T., & Møller, B.L. (2020). Phytocannabinoids: Origins and biosynthesis. Trends in Plant Science, 25(10), 985-1004.
https://doi.org/10.1016/j.tplants.2020.07.004 - Moreno-Sanz, G. (2016). Neuropharmacology of new psychoactive substances: THC and cannabinoids. Advances in Pharmacology, 76, 185-218.
https://www.sciencedirect.com/science/article/pii/S1054358916300076 - Fellermeier, M., & Zenk, M.H. (1998). Prenylation of olivetolate by a Cannabis sativa aromatic prenyltransferase. The Plant Journal, 15(3), 335-344.
https://onlinelibrary.wiley.com/doi/full/10.1046/j.1365-313x.1998.00195.x - Andre, C.M., Hausman, J.F., & Guerriero, G. (2016). Cannabis sativa: The plant of the thousand and one molecules. Frontiers in Plant Science.
https://www.frontiersin.org/articles/10.3389/fpls.2016.01019/full - Hazekamp, A. (2018). The trouble with CBD oil. Medical Cannabis and Cannabinoids.
https://www.karger.com/Article/FullText/489963 - De Petrocellis, L., & Di Marzo, V. (2010). Role of endocannabinoids and endovanilloids in Ca2+ signaling. Cell Calcium, 47(2), 213-220.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2838477/ - ElSohly, M.A., & Radwan, M.M. (2017). Cannabis Chemistry and Pharmacology. Springer International Publishing.
https://link.springer.com/book/10.1007/978-3-319-45052-9 - Berman, P., Futoran, K., Lewitus, G.M., & Mechoulam, R. (2018). Identification of the cannabinoid CB1 receptor binding site. Neuropharmacology.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6130450/ - Rice, K.C., & Zoghbi, S.S. (2017). Pharmacological effects of tetrahydrocannabivarin. Current Topics in Behavioral Neurosciences.
https://link.springer.com/chapter/10.1007/7854_2017_35 - Lewis, M.A., Russo, E.B., & Smith, K.M. (2018). Pharmacological Foundations of Cannabis Therapeutics. Neuropharmacology.
https://www.sciencedirect.com/science/article/pii/S0028390818301019 - NIDA (National Institute on Drug Abuse) – Cannabis Research.
https://nida.nih.gov/research-topics/marijuana - PubChem – THCVA compound summary
https://pubchem.ncbi.nlm.nih.gov/compound/Tetrahydrocannabivarinic-acid - NCBI Bookshelf – Cannabinoids: Overview and Pharmacology
https://www.ncbi.nlm.nih.gov/books/NBK207145/