Упродовж останніх десятиліть увага науковців, медиків і фармакологів дедалі більше зосереджується на глибшому розумінні складних регуляторних систем, що підтримують рівновагу в організмі. Однією з таких ключових систем, яку лише нещодавно почали широко досліджувати, є ендоканабіноїдна система. Попри її назву, вона є не лише пов’язаною з канабісом, а й універсальною біологічною мережею, що функціонує в організмі незалежно від зовнішнього впливу канабіноїдів. Її відкриття відкрило нову епоху у біомедицині, фармакології та розумінні гомеостазу.
Перш ніж підсумовувати, важливо ще раз уточнити: що таке ендоканабіноїдна система? Це комплекс рецепторів, ендогенних лігандів (тобто природних сполук, які виробляє сам організм) і ферментів, які разом регулюють широкий спектр фізіологічних процесів. До ключових компонентів системи належать канабіноїдні рецептори типу 1 (CB1) і типу 2 (CB2), а також ендогенні канабіноїди – зокрема анандамід та 2-АГ – і ферменти, які відповідають за їх синтез і розщеплення.
На момент відкриття ендоканабіноїдної системи в 1990-х роках, науковий світ був вражений її всеохоплюючим впливом на такі життєво важливі процеси, як настрій, пам’ять, апетит, біль, запалення, імунна відповідь, регуляція сну, моторика тощо. Це вказує на те, що ендоканабіноїдна система діє не ізольовано, а у взаємодії з багатьма іншими системами – нервовою, імунною, ендокринною.
Сучасні наукові дослідження демонструють, що дисфункція або дефіцит ендоканабіноїдної системи може відігравати важливу роль у розвитку хронічних захворювань. До таких можуть належати синдром подразненого кишечника, мігрень, фіброміалгія, депресія, ПТСР, тривожні розлади, а також деякі аутоімунні захворювання. Відомий науковий термін – клінічний ендоканабіноїдний дефіцит – описує стан, за якого природні канабіноїди виробляються в недостатній кількості, що порушує здатність організму до саморегуляції.
Окрему роль у дослідженні цієї системи відіграє взаємодія з фітоканабіноїдами – тобто сполуками рослини канабіс, які мають здатність впливати на ендоканабіноїдну систему людини. Найвідоміші з них – тетрагідроканабінол (ТГК) та канабідіол (КБД) – стали об’єктом численних клінічних випробувань. Вони діють через рецептори CB1 і CB2, які широко розповсюджені в головному мозку, центральній нервовій системі, імунних клітинах та внутрішніх органах. Таким чином, канабіс не є “зовнішнім” агентом у класичному сенсі – його компоненти вписуються в уже існуючу біохімічну систему організму.
Однак, відповідь на запитання “що таке ендоканабіноїдна система” не обмежується лише переліком рецепторів і молекул. Йдеться про цілісну концепцію – про те, як організм підтримує стабільність у мінливих умовах зовнішнього і внутрішнього середовища. ЕКС діє подібно до термостату, “відчуваючи” відхилення від норми і активуючи відповідні механізми відновлення рівноваги. Цей принцип, відомий як гомеостаз, є центральним у сучасній фізіології.
З огляду на все вищезазначене, можна стверджувати, що ендоканабіноїдна система має надзвичайно важливе значення для загального здоров’я. Вона виступає невидимим регулятором, який забезпечує адаптивність, стабільність та відновлення після стресу, травм або інфекцій. І хоча сьогодні ми лише починаємо по-справжньому усвідомлювати її роль, уже зараз можна говорити про величезний потенціал її використання в терапії.
Наприклад, у нейропсихіатрії розглядається можливість модуляції ЕКС для лікування депресії, тривожних розладів, ПТСР. У онкології – для знеболення та покращення якості життя пацієнтів. У неврології – для зменшення судом при епілепсії. І що цікаво, деякі країни вже офіційно дозволяють медичне застосування канабіноїдів у відповідних клінічних показаннях.
Проте необхідно розуміти, що активне втручання в ендоканабіноїдну систему – це сфера, яка потребує точного дозування, контролю та глибокого розуміння. Безсистемне або надмірне застосування фітоканабіноїдів може призвести до небажаних ефектів, включно з порушеннями когнітивної функції, залежністю чи ендогенним дисбалансом.
Історія відкриття ендоканабіноїдної системи
Перші відкриття канабіноїдів
Історія відкриття канабіноїдів починається задовго до розуміння їхньої дії на організм. Протягом тисячоліть рослина Cannabis sativa використовувалася в медичних і ритуальних цілях у Китаї, Індії, на Близькому Сході. Проте лише у XIX столітті почалися перші спроби виділити активні компоненти канабісу хімічними методами. Попри це, справжній прорив відбувся у XX столітті, коли з’явилися технології хроматографії та спектроскопії, які дозволили точно визначити хімічну структуру речовин, присутніх у рослині.
Першим ізоляцією активного компонента канабісу успішно займався британський хімік Роберт Чейз у 1940-х роках, але саме ізраїльський вчений Рафаель Мешулам разом зі своєю командою здійснив ключове відкриття в 1960-х. У 1963 році вони вперше описали структуру канабідіолу (CBD), одного з основних непсихоактивних компонентів канабісу. CBD не викликає змін свідомості, але має виражені протизапальні, нейропротекторні та анксіолітичні властивості.
У 1964 році Мешулам вперше ідентифікував і повністю охарактеризував тетрагідроканабінол (THC) – психоактивну речовину, яка відповідає за більшість ефектів, які зазвичай асоціюють з вживанням марихуани. Це відкриття стало історичним, оскільки воно дало перше наукове пояснення психоактивним властивостям канабісу. THC був визнаний головним екзогенним канабіноїдом, тобто зовнішньою сполукою, яка впливає на біохімію організму.
Особливу увагу дослідники звернули на те, що THC діє дуже специфічно, наче взаємодіє з певною молекулярною “мишенню” в організмі. Але на той момент сама “мишень” – рецептор, до якого приєднувався THC, – залишалася невідомою. Це викликало хвилю подальших досліджень, адже якщо існує такий ефект, то в організмі повинні бути специфічні структури, здатні реагувати на канабіноїди.
Окремо варто відзначити, що дослідження канабіноїдів велося в умовах регуляторних обмежень. Після 1970-х років канабіс був заборонений у багатьох країнах, що суттєво обмежило наукові експерименти. Попри це, вчені з декількох країн продовжували пошуки механізмів дії цих речовин на організм. Тоді стало зрозуміло, що THC – не єдина активна речовина, і що канабіс містить понад 100 різних канабіноїдів, кожен із яких має унікальний фармакологічний профіль.
Відкриття рецепторів CB1 і CB2
Ключовий етап у вивченні механізмів дії канабіноїдів був досягнутий лише тоді, коли дослідники виявили, з чим саме ці речовини взаємодіють у клітинах. До 1980-х років існувало припущення, що THC повинен зв’язуватися з якимись специфічними рецепторами, проте їхнє існування залишалося гіпотезою. Злам настав у 1988 році, коли вчені з Університету Сент-Луїса, США, використали радіоактивно мічений THC, щоби дослідити його зв’язування в головному мозку щурів. Вони виявили наявність високоспецифічних ділянок зв’язування – це свідчило про існування нового типу рецепторів.
У 1990 році дослідницька група на чолі з Лізою Матсуда з Національного інституту психічного здоров’я США клонувала перший канабіноїдний рецептор – CB1. Цей рецептор виявився широко розповсюдженим у головному мозку, особливо у таких ділянках, як гіпокамп (пам’ять), мозочок (координація) і базальні ганглії (рухова активність). Саме CB1 виявився основною мішенню для психоактивної дії THC. Він належить до великої групи рецепторів, відомих як G-білково зв’язані рецептори – це тип мембранних структур, які активують внутрішньоклітинні сигнали після взаємодії з лігандом.
Другий тип рецептора – CB2 – був відкритий у 1993 році. Його експресія була виявлена переважно в клітинах імунної системи, селезінці, мигдаликах та інших периферичних тканинах. Хоча CB2 не бере участі у психоактивних ефектах, він відіграє критичну роль у регуляції запалення, імунної відповіді та клітинного гомеостазу. На відміну від CB1, цей рецептор майже не зустрічається у головному мозку, хоча деякі дослідження довели його присутність у мікроглії – клітинах, відповідальних за імунний захист нервової тканини.
Коли була відкрита ендоканабіноїдна система
Поняття ендоканабіноїдної системи виникло не одномоментно. Його формування стало результатом поетапних відкриттів: ідентифікації екзогенних канабіноїдів, відкриття відповідних рецепторів CB1 і CB2, а також ізоляції ендогенних сполук, які ці рецептори активують. Якщо конкретно говорити про те, коли була відкрита ендоканабіноїдна система, то ключовою датою вважається 1992 рік. Саме тоді група Рафаеля Мешулама виявила і описала перший природний ліганд до CB1-рецептора – анандамід (N-арахідоноілетаноламід). Ця молекула виявилася надзвичайно подібною до THC за фармакологічними властивостями, але виробляється самою нервовою тканиною.
Друге ендоканабіноїдне з’єднання – 2-арахідоноїлгліцерол (2-AG) – було виявлено у 1995 році. Обидві речовини мають здатність активувати як CB1, так і CB2, але в різних концентраціях і контекстах. З цим відкриттям стало очевидно, що організм має власну внутрішню канабіноїдну систему, яка працює незалежно від вживання рослинних препаратів. Так сформувалося поняття “ендоканабіноїдна система” як інтегрованої регуляторної мережі.
Щоби зрозуміти що таке ендоканабіноїдна система і яка її роль, потрібно вийти за межі хімічних формул. Це система зворотного регулювання: вона активується лише тоді, коли відбувається фізіологічне навантаження, стрес або порушення гомеостазу. Її дія короткочасна і локалізована – анандамід і 2-AG швидко синтезуються “на місці” і так само швидко руйнуються, не зберігаючись у запасі. Цей механізм дозволяє організму адаптуватися до умов, коригувати збудження нейронів, модулювати біль, апетит, сон і навіть емоційні реакції.
Система також взаємодіє з іншими сигнальними системами – дофаміновою, серотоніновою, глутаматною, що підтверджує її центральне місце в нейрофізіології. Окрім того, рецептори CB1 і CB2 виявлено майже у всіх тканинах тіла, що дозволяє ендоканабіноїдній системі координувати реакції як на рівні клітини, так і організму в цілому.
Будова та складові ендоканабіноїдної системи
Ендоканабіноїдна система – це складна сигнальна мережа, яка виконує регуляторні функції в багатьох фізіологічних процесах організму. Вона діє на клітинному рівні й відповідає за підтримання гомеостазу – тобто внутрішньої рівноваги між збудженням і гальмуванням, між активністю й відновленням. Унікальність цієї системи полягає в тому, що вона активується лише тоді, коли організм виходить зі стану рівноваги, реагуючи на фізичні, хімічні або емоційні подразники. Будова ендоканабіноїдної системи охоплює три основні групи елементів: рецептори, ендогенні канабіноїди (ендоканабіноїди) і ферменти, які відповідають за синтез і розщеплення цих молекул.
У центрі цієї системи стоять два головних рецептора – CB1 і CB2. Вони розташовані на поверхні клітин і є білками, що активують внутрішньоклітинні сигнальні каскади після взаємодії з відповідними лігандами. CB1-рецептори найбільш активно експресуються у центральній нервовій системі, зокрема в ділянках, що відповідають за пам’ять, координацію, емоції та больове сприйняття. Натомість CB2-рецептори переважно локалізуються у клітинах імунної системи, де вони регулюють запальні реакції, фагоцитоз і вивільнення цитокінів. Існують також менш вивчені рецептори, які можуть брати участь у дії ендоканабіноїдів, наприклад, GPR55 або TRPV1, однак CB1 і CB2 залишаються основними мішенями.
Наступною ключовою складовою є самі ендоканабіноїди – сигнальні молекули, що виробляються клітинами організму за потреби. Найбільш дослідженими з них є анандамід (AEA) та 2-арахідоноїлгліцерол (2-AG). Обидві ці речовини синтезуються з ліпідних прекурсорів у клітинних мембранах і діють короткочасно, активуючи рецептори в безпосередній близькості від місця синтезу. Анандамід, який отримав назву від санскритського слова “ананда” (блаженство), пов’язаний із регуляцією настрою, тривожності, апетиту та сну. 2-AG виконує подібні функції, однак має вищу концентрацію у мозку й потужніший ефект на CB2-рецептори.
Не менш важливими є ферменти, які контролюють рівень ендоканабіноїдів у тканинах. Вони відповідають за швидке руйнування сигналів, щойно досягнуто потрібного ефекту. Основним ферментом деградації анандаміду є FAAH (жирнокислотна амідгідролаза), а для 2-AG – MAGL (моноацилгліцеролліпаза). Ці ферменти регулюють тривалість і інтенсивність сигналу, гарантуючи, що ендоканабіноїдна активність залишиться контрольованою й локалізованою.
Загальна архітектура ендоканабіноїдної системи забезпечує їй унікальні можливості. На відміну від більшості нейротрансмітерних систем, ця система працює за принципом зворотної передачі сигналу: ендоканабіноїди синтезуються в постсинаптичній клітині й діють на пресинаптичні рецептори, пригнічуючи вивільнення нейромедіаторів. Такий механізм дозволяє швидко й ефективно регулювати надлишкову активність нейронів, що особливо важливо в умовах стресу, болю або патологічної збудженості.
Крім центральної нервової системи, ендоканабіноїдна система охоплює численні периферичні органи: шлунково-кишковий тракт, печінку, серце, шкіру, статеву систему, імунні органи. Вона бере участь у численних фізіологічних процесах: метаболізмі глюкози, ліпідів, регуляції апетиту, енергетичного балансу, імунної відповіді, болю, запалення, репродукції. Завдяки своїй універсальності та здатності до адаптивної регуляції, ця система розглядається як потенційна мішень для терапії широкого спектра захворювань – від епілепсії й депресії до аутоімунних розладів і онкології.
Опис будови ендоканабіноїдної системи неможливий без урахування її високої інтеграції з іншими сигнальними мережами. Ендоканабіноїдні рецептори безпосередньо або опосередковано взаємодіють з дофаміновою, серотоніновою, опіоїдною системами. Це пояснює їхню роль у модулюванні задоволення, болю, тривоги, мотивації та сну. Сама система функціонує як тонкий біологічний модератор, який підтримує нейрохімічну рівновагу без надмірного втручання – доти, доки не настає фізіологічна потреба.
Основні елементи: рецептори, ендоканабіноїди, ферменти
Ендоканабіноїдна система складається з трьох ключових структурних компонентів: рецепторів CB1 і CB2, ендоканабіноїдних лігандів (анандаміду й 2-AG) та ферментів, що регулюють їх біосинтез і деградацію. Ці елементи взаємодіють у реальному часі, забезпечуючи динамічну модифікацію нейрональної та імунної активності залежно від фізіологічного контексту. Хоча вони функціонують як єдине ціле, кожен із них має унікальні молекулярні властивості, механізми дії та функціональні особливості.
Рецептори CB1 є мембранозв’язаними G-білок-залежними рецепторами, що кодуються геном CNR1, який розташований на хромосомі 6 (6q14-q15 у людини). Їхня молекулярна маса становить приблизно 53 кДа, і вони мають сім трансмембранних доменів. Висока концентрація CB1 виявляється в неокортексі, гіпокампі, базальних гангліях, мозочку та інших структурах центральної нервової системи. На клітинному рівні вони локалізуються переважно на пресинаптичних терміналях, де регулюють вивільнення нейромедіаторів, зокрема глутамату, ГАМК, дофаміну та ацетилхоліну. Активація CB1 інгібує аденілатциклазу, зменшує активність кальцієвих каналів, стимулює відкриття калієвих каналів, що призводить до гіперполяризації мембрани та пригнічення нейротрансмітерного вивільнення.
Рецептори CB2, закодовані геном CNR2 (локалізованим на хромосомі 1p36), мають схожий загальний план будови з CB1, але суттєво відрізняються за патернами експресії. Вони наявні в імунних клітинах (макрофагах, Т-лімфоцитах, нейтрофілах, дендритних клітинах), селезінці, кістковому мозку та в меншій кількості в ЦНС, переважно в мікроглії. Стимуляція CB2 не впливає безпосередньо на нейромедіаторну передачу, проте модулює вивільнення цитокінів, хемотаксис і клітинну проліферацію. Їхнє активаційне середовище пов’язане переважно з імунною відповіддю, запаленням і модуляцією тканинного пошкодження.
На рівні ендогенних лігандів головну роль відіграють анандамід (AEA) та 2-арахідоноїлгліцерол (2-AG). Обидва належать до класу жирнокислотних похідних, але відрізняються хімічною структурою, шляхами синтезу та фармакологічним профілем. Анандамід синтезується з N-арахідоноїлфосфатидилетаноламіну (NAPE) за участі NAPE-фосфоліпази D. Його біологічна активність обмежена коротким періодом напівжиття, який триває лише кілька секунд через швидке ферментативне руйнування. Анандамід є частковим агоністом CB1 і має низьку спорідненість до CB2, однак також здатний взаємодіяти з рецепторами TRPV1, що відповідають за температурну чутливість і ноцицепцію.
2-AG утворюється з діацилгліцеролів (DAG) у результаті дії DAG-ліпази α/β. На відміну від анандаміду, він є повним агоністом як CB1, так і CB2-рецепторів, демонструючи ширший спектр ефектів. Його концентрація в мозку перевищує рівень AEA у 100-1000 разів, що підкреслює його домінантну роль у тонкій модуляції синаптичної передачі. Крім цього, 2-AG бере участь у регуляції судинного тонусу, нейрозапалення, а також впливає на клітинну адгезію через інтегрини та інші молекули адгезії.
Ферментативна система контролює рівні ендоканабіноїдів у тканинах, визначаючи їх біодоступність і тривалість дії. Основним ферментом деградації анандаміду є жирнокислотна амідгідролаза (FAAH) – серинова гідролаза, локалізована в цитоплазмі. Вона розщеплює AEA до арахідонової кислоти та етаноламіну. Мутації в гені FAAH можуть бути пов’язані з підвищеним больовим порогом, зниженою тривожністю та зменшеною інтенсивністю негативного афективного реагування. На основі її інгібіторів створюються фармакологічні препарати з потенційною анальгетичною, анксолітичною та антидепресивною дією.
Для 2-AG основним катаболічним ферментом є моноацилгліцеролліпаза (MAGL), яка гідролізує 2-AG до гліцеролу та арахідонової кислоти. MAGL експресується як у нейронах, так і в астроцитах і має високу активність у сірій речовині мозку. При її пригніченні підвищується концентрація 2-AG, що може мати анальгетичний ефект, але також спричиняти розвиток толерантності та десенситизації рецепторів CB1. Крім MAGL, у метаболізмі 2-AG беруть участь ферменти ABHD6 і ABHD12, які відіграють допоміжну, але важливу роль у тканинах із низькою активністю MAGL.
Слід також згадати про ряд регуляторних білків, які не беруть безпосередньої участі в гідролізі чи синтезі ендоканабіноїдів, але впливають на їх транспорт і локалізацію. Один із них – FABP (fatty acid-binding proteins), який бере участь у транспортуванні анандаміду до FAAH у клітині. Пригнічення цього білка може призвести до зниження деградації AEA без впливу на FAAH як фермент, що є перспективним напрямом фармакологічної модуляції.
Особливістю структури ендоканабіноїдної системи є те, що її елементи не зберігаються у стабільному активному стані. Синтез ендоканабіноїдів запускається “за потреби” (on demand), а рецептори можуть проходити швидку десенситизацію або внутрішню інтерналізацію при надмірній стимуляції. Це дає системі високу пластичність, що відрізняє її від більшості класичних нейротрансмітерних або гормональних систем. Усе це робить її надзвичайно чутливою до змін внутрішнього та зовнішнього середовища, забезпечуючи ефективну й швидку реакцію в умовах коливань фізіологічного балансу.
Типи рецепторів і їх локалізація в тілі
У структурі ендоканабіноїдної регуляції рецептори типу CB1 і CB2 відіграють центральну роль як основні точки зв’язку між сигнальними молекулами та клітинними відповідями. Хоча вони поділяють загальні механізми активації через G-білок-залежні каскади, їх розподіл в організмі людини демонструє чітку функціональну спеціалізацію. CB1-рецептори домінують у центральній і периферичній нервовій системі, тоді як CB2 сконцентровані в імунних і гемопоетичних структурах. Такий розподіл забезпечує точкову модифікацію фізіологічних процесів, включаючи ноцицепцію, моторну координацію, емоційну реактивність, запальні механізми, енергетичний метаболізм та інші аспекти гомеостатичного контролю.
CB1-рецептори виявляються з надзвичайно високою щільністю в головному мозку, зокрема в зонах, відповідальних за когнітивну інтеграцію, пам’ять, мотивацію та контроль рухів. Найбільша концентрація зафіксована в гіпокампі (регуляція короткочасної пам’яті), базальних гангліях (рухова активність), неокортексі (вищі когнітивні функції) та мозочку (координація рухів і рівновага). У гіпоталамусі CB1 модулюють апетит і енергетичний обмін, а в мигдалеподібному тілі беруть участь у регуляції емоційної реактивності, зокрема тривоги та страху. У стовбурових ядрах мозку активація цих рецепторів впливає на больову чутливість, терморегуляцію й автономну функцію.
У спинному мозку CB1 локалізуються в дорзальних рогах, де вони пригнічують передачу больових сигналів від периферії до ЦНС. Їхня активація в цих зонах знижує вивільнення глутамату та субстанції P, послаблюючи інтенсивність ноцицептивної відповіді. На рівні сітківки ока CB1-рецептори модулюють електрофізіологічну активність гангліозних клітин, впливаючи на адаптацію до світла.
Поза межами нервової системи CB1 присутні в периферичних нейронах автономної нервової системи, зокрема у вагусі, симпатичних гангліях та ентеральних нейронах. Їхня активація призводить до зміни моторики кишечника, секреції ферментів і кровотоку у внутрішніх органах. У жировій тканині ці рецептори беруть участь у регуляції ліпогенезу, в печінці — у глюконеогенезі, а в підшлунковій залозі — у секреції інсуліну.
CB2-рецептори зосереджені переважно в імунних клітинах як в периферійній крові, так і в тканинах. Найвища експресія виявлена в В- і Т-лімфоцитах, макрофагах, нейтрофілах, дендритних клітинах і мікроглії. У селезінці, мигдаликах, кістковому мозку та лімфатичних вузлах CB2 виконують роль інгібіторів запальної відповіді: зменшують продукцію прозапальних цитокінів, пригнічують проліферацію активованих імунних клітин та знижують хемотаксис. У мікроглії мозку активація CB2 пригнічує нейрозапалення, знижуючи вироблення IL-1β, TNF-α і NO. У астроцитах їхня дія проявляється через контроль локального гомеостазу та захист нейронів від токсичного впливу запальних медіаторів.
CB2 також експресуються в тканинах периферичних органів: у кишковому епітелії, шкірі, легенях і кістках. У шлунково-кишковому тракті вони контролюють баланс між толерантністю до мікробіоти та імунною відповіддю. У шкірі рецептори CB2 залучені до процесів загоєння, регенерації та гальмування патологічної проліферації клітин, зокрема при псоріазі або дерматитах. У кістковій тканині CB2 активуються в остеобластах та остеокластах, модулюючи баланс між кістковим формуванням і резорбцією. В легенях вони проявляють себе при запальних ураженнях та астматичних реакціях.
Окрему категорію становлять нестандартні канабіноїдні рецептори, які не належать до CB1 або CB2, але реагують на ендоканабіноїди чи канабіноїдні агоністи. До них відносяться GPR55, GPR18, TRPV1 та PPARs. Рецептор GPR55 експресується в кісткових клітинах, наднирниках і в деяких ділянках мозку, зокрема у стовбурі. Його активація стимулює кальцієву сигналізацію, проліферацію клітин і може бути пов’язана з болем та запаленням. TRPV1 (ванілоїдний рецептор), на який також діє анандамід, локалізується в сенсорних нейронах і бере участь у терморегуляції та сприйнятті болю. PPAR-α та PPAR-γ, ядерні рецептори, активуються метаболітами ендоканабіноїдів і регулюють експресію генів, пов’язаних із метаболізмом ліпідів і запаленням.
У серцево-судинній системі CB1 і CB2 виконують протилежні функції. CB1 сприяють вазодилатації через інгібування вивільнення норадреналіну з симпатичних нейронів, знижуючи артеріальний тиск. CB2, у свою чергу, захищають ендотелій від окисного стресу та зменшують адгезію моноцитів до судинної стінки. У міокарді обидва типи рецепторів впливають на метаболізм, апоптоз та ішемічну резистентність.
У репродуктивній системі CB1 виявляються в гіпоталамо-гіпофізарно-гонадній осі, регулюючи секрецію гонадотропінів, овуляцію та сперматогенез. CB2 експресуються в тестикулярних клітинах Лейдіга, де модулюють синтез тестостерону. У жіночій статевій системі вони локалізуються в ендометрії, плаценті та фолікулах яєчників, регулюючи імплантацію ембріона й підтримку вагітності.
Експресія обох типів рецепторів варіює залежно від віку, статі, гормонального стану, патологій та навіть циркадного ритму. Їхня активність модулюється не лише ендогенними лігандами, а й численними зовнішніми факторами — дієтою, стресом, фізичними навантаженнями, впливом ліків і токсинів. Встановлено, що деякі захворювання супроводжуються зміною експресії CB1 або CB2: наприклад, при ожирінні спостерігається гіперекспресія CB1 у гіпоталамусі, а при автоімунних хворобах — підвищення активності CB2 в імунних клітинах.
Через які рецептори канабіс взаємодіє з ендоканабіноїдною системою нашого організму
Механізм дії канабісу на людський організм визначається його здатністю безпосередньо або опосередковано взаємодіяти з рецепторами ендоканабіноїдної системи. Основну роль у цьому процесі відіграють канабіноїдні рецептори CB1 і CB2, однак вплив канабіноїдів не обмежується лише цими двома структурами. Біоактивні компоненти канабісу, зокрема Δ9-тетрагідроканабінол (ТГК) і канабідіол (КБД), мають різну спорідненість до низки молекулярних мішеней, що забезпечує широкий спектр їхньої фармакологічної активності.
Основний психоактивний компонент канабісу – ТГК – виступає потужним частковим агоністом CB1-рецепторів. Його висока спорідненість до цих рецепторів, локалізованих переважно в головному мозку, пояснює характерний психотропний ефект. Приєднуючись до CB1, ТГК ініціює каскад внутрішньоклітинної сигналізації, що пригнічує вивільнення нейромедіаторів, зокрема глутамату, ГАМК, ацетилхоліну, дофаміну та норадреналіну. Це зумовлює зміни в когнітивному сприйнятті, порушення короткочасної пам’яті, підвищену емоційну лабільність, зміни моторної активності та змінену сенсорну обробку.
У той же час ТГК активує CB2-рецептори, хоча з меншою ефективністю. Ця взаємодія впливає на імунну відповідь, зменшуючи синтез прозапальних цитокінів та модулюючи проліферацію імунних клітин. У клінічних умовах це проявляється як потенційний протизапальний і імунорегуляторний ефект, особливо в контексті аутоімунних чи запальних захворювань.
Канабідіол (КБД), хоча й не має високої афінності до CB1 і CB2, модулює їхню активність опосередковано. Зокрема, КБД діє як негативний алостеричний модулятор CB1, що знижує ефективність зв’язування ТГК до цього рецептора. Це пояснює, чому продукти з високим вмістом КБД можуть зменшувати психоактивний вплив ТГК. Крім того, КБД підвищує ендогенну концентрацію анандаміду, інгібуючи його розщеплення ферментом FAAH, тим самим посилюючи тонус ендоканабіноїдної системи через ендогенні механізми.
Крім класичних канабіноїдних рецепторів, активні речовини канабісу також взаємодіють з альтернативними мішенями. Однією з них є GPR55 – сиротливий рецептор, що часто називається “третім канабіноїдним рецептором”. ТГК і деякі інші фітоканабіноїди можуть активувати GPR55, що викликає протилежні ефекти у порівнянні з CB1/CB2, зокрема стимулювання клітинної проліферації або посилення болю. Його значення особливо помітне в контексті онкології, оскільки він виявляється в деяких пухлинних клітинах і потенційно модулює агресивність пухлин.
TRPV1 (ванілоїдний рецептор типу 1) – ще одна мішень, з якою взаємодіє КБД. Цей іонний канал активується температурою, кислотами та іншими подразниками, беручи участь у формуванні больової чутливості. КБД виступає як агоніст TRPV1, що пояснює його потенційний анальгетичний і протизапальний ефект. У деяких випадках тривала активація TRPV1 КБД призводить до десенситизації рецептора, що може зменшити гіперчутливість при хронічному болю.
Крім того, КБД модулює сигнальні шляхи через ядерні рецептори – зокрема PPAR-γ. Цей транскрипційний фактор відіграє ключову роль у регуляції метаболізму глюкози, жирової тканини та запалення. Активація PPAR-γ КБД має перспективи при лікуванні метаболічного синдрому, діабету 2 типу та деяких форм нейродегенерації.
У центральній нервовій системі вплив канабісу через CB1-рецептори проявляється у різних ділянках. У гіпокампі пригнічується синаптична пластичність, що впливає на запам’ятовування. У базальних гангліях модулюється моторна функція, а в мезолімбічному дофаміновому шляху змінюється мотиваційна поведінка. Встановлено, що надмірна активація CB1 у цій системі сприяє зміні реакції на винагороду, що частково пояснює аддиктивний потенціал канабісу.
На периферії, взаємодія ТГК з CB1 у ентеральній нервовій системі пригнічує моторику шлунково-кишкового тракту, що клінічно проявляється у вигляді зниження перистальтики та апетиту. Через CB2 на імунних клітинах канабіс може зменшити секрецію ІЛ-6, ІЛ-1β, TNF-α та інших ключових медіаторів запалення, що пояснює його ефективність при хронічних запальних захворюваннях, таких як хвороба Крона, ревматоїдний артрит чи розсіяний склероз.
У дерматології взаємодія канабіноїдів з CB1 і CB2 у шкірі регулює проліферацію кератиноцитів, секрецію себуму та активацію місцевих імунних клітин. Це відкриває терапевтичні перспективи для лікування акне, псоріазу та атопічного дерматиту.
Варто зазначити, що канабіноїди можуть взаємодіяти не лише з рецепторами ендоканабіноїдної системи, але й змінювати активність транспортних білків, які регулюють надходження ендоканабіноїдів у клітини. Наприклад, КБД може блокувати FABP – білки, що переносять анандамід до FAAH для деградації, тим самим непрямо підвищуючи рівень анандаміду в тканинах.
Фармакологічний профіль кожного канабіноїду залежить не лише від його спорідненості до рецепторів, а й від метаболічних перетворень. Наприклад, 11-гідрокси-ТГК – активний метаболіт ТГК, що утворюється в печінці після перорального споживання, має ще вищу спорідненість до CB1, тому психоактивні ефекти їжі з канабісом зазвичай сильніші та триваліші, ніж при інгаляції.
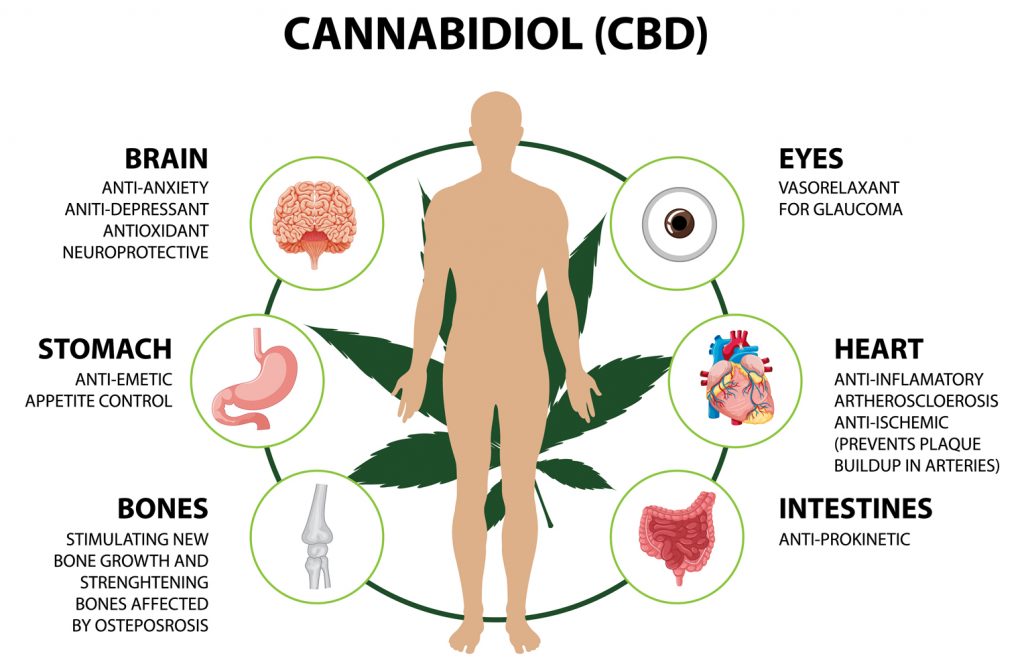
Фізіологічні функції ендоканабіноїдної системи
Ендоканабіноїдна система (ЕКС) – це універсальна сигнальна мережа, що виконує низку регуляторних функцій у тілі людини. Її присутність зафіксована практично в усіх органах і тканинах, від головного мозку до периферичних клітин імунної системи, а її фізіологічна активність є критичною для підтримки динамічної рівноваги в організмі. Роль ЕКС полягає не в ініціюванні якихось процесів, а у регулюванні вже активних механізмів на клітинному рівні, що дозволяє організму швидко реагувати на зміни середовища, інфекції, пошкодження чи стресові фактори.
Основу регуляторної дії системи становить її здатність інтегрувати сигнали між різними функціональними осями: нервовою, ендокринною, імунною, метаболічною. Завдяки цьому вона бере участь у контролі над широким спектром процесів: болем, запаленням, енергетичним балансом, настроєм, апетитом, терморегуляцією, моторикою, сном і пам’яттю. Наприклад, у стані запалення ендоканабіноїдна система локально підвищує вироблення ендогенних канабіноїдів, які, активуючи CB2-рецептори на імунних клітинах, знижують продукцію прозапальних цитокінів. Аналогічно, при гострому болю чи травмі, посилюється вивільнення анандаміду в синапсах спинного мозку та мозкових структурах, що зменшує проведення больового імпульсу.
Окремо варто звернути увагу на участь системи в короткострокових та довгострокових нейрональних змінах. CB1-рецептори, присутні в зонах мозку, відповідальних за навчання та пам’ять, відіграють роль у формуванні довготривалого потенціювання (LTP) або пригнічення (LTD), тим самим регулюючи нейропластичність. Це має велике значення як для нормального когнітивного функціонування, так і для процесів адаптації до стресу, нових ситуацій або зміни оточення.
У центральній нервовій системі ЕКС діє як “фільтр сигналів” – вона не пригнічує всю нейрональну активність, а тонко налаштовує інтенсивність збудження. Це дозволяє знизити нейрональний “шум” і підтримувати баланс між збудженням і гальмуванням. На практиці це проявляється у здатності організму краще переносити сенсорні перевантаження, тривожні стани чи емоційні збудження.
На метаболічному рівні ендоканабіноїдна система координує процеси зберігання та витрати енергії. CB1-рецептори, що експресуються в гіпоталамусі, контролюють сигнал голоду і насичення, а також регулюють чутливість до інсуліну через периферійні механізми. При надмірній активації системи може виникати енергетичний дисбаланс, який сприяє розвитку ожиріння, інсулінорезистентності й метаболічного синдрому. З іншого боку, при гіпофункції цієї системи виникають протилежні проблеми – гіпометаболізм, знижений апетит, кахексія.
В імунній системі ЕКС функціонує як фактор контролю над запальною відповіддю. CB2-рецептори активно експресуються на макрофагах, Т-клітинах, мікроглії, де вони модулюють їх активацію й цитокіновий профіль. Це забезпечує механізм “відкату” після гострої запальної реакції, щоб уникнути хронічного пошкодження тканин. Дисфункція цих механізмів може сприяти розвитку аутоімунних захворювань або персистентного запалення.
Важливою характеристикою цієї системи є її “попитозалежність” – активність ендоканабіноїдів не підтримується постійно, а виникає за потребою, в конкретному локальному середовищі. Це відрізняє її від більшості класичних нейротрансмітерних або гормональних систем, у яких є фоновий рівень активності. Таке регулювання дозволяє точкову і тимчасово обмежену активацію, що знижує ризик побічних ефектів і надмірної реакції.
У рамках фізіології стресу, ендоканабіноїдна система виступає як буферна структура, яка пригнічує гіперактивацію осі “гіпоталамус-гіпофіз-наднирники”. В експериментальних моделях пригнічення CB1-рецепторів підвищує рівні кортизолу і тривожності, в той час як їх активація зменшує реакцію на стресові стимули. Таким чином, ЕКС не лише реагує на стрес, а й формує емоційну стабільність і адаптивність організму.
Серед численних фізіологічних процесів, у яких бере участь ця сигнальна мережа, особливе місце займає її роль у розвитку – як пренатальному, так і постнатальному. Рецептори CB1 беруть участь у формуванні нейрональних мереж, міграції клітин у ембріональному мозку, синаптогенезі, а також дозріванні гліальних клітин. Це робить ендоканабіноїдну систему критично важливою у ранньому онтогенезі, а її дисфункція – можливою причиною нейропсихіатричних розладів.
Регуляція болю, настрою, апетиту
Ендоканабіноїдна система виступає критичною внутрішньою ланкою, що забезпечує гнучке регулювання ключових сенсорних і афективних процесів: ноцицепції (відчуття болю), афективної поведінки (настрій) та метаболічної мотивації (апетит). Ці процеси є взаємопов’язаними як з погляду нейрональної архітектури, так і через спільні молекулярні шляхи, і ендоканабіноїдна система координує їхню роботу через локалізовану та контекстно-залежну модуляцію синаптичної передачі.
У випадку болю, ендоканабіноїдна система бере участь на всіх рівнях його обробки – від периферичних ноцицепторів до вищих інтегративних центрів у корі головного мозку. CB1-рецептори у дорсальних корінцях спинного мозку зменшують виділення збуджуючих нейротрансмітерів (зокрема, глутамату та субстанції P) у відповідь на периферичне подразнення. Це знижує інтенсивність передачі больового сигналу ще до того, як він досягне вищих структур. Водночас, у таламусі й мигдалеподібному тілі канабіноїдна активація пригнічує формування емоційного забарвлення болю, а в лобових структурах кори впливає на когнітивну оцінку ситуації.
В експериментальних умовах встановлено, що підвищення концентрації ендоканабіноїдів, зокрема анандаміду, супроводжується зменшенням чутливості до механічної та термічної ноцицепції. Це доводиться як фармакологічними методами, так і генетичними моделями, де нокаут ферментів, що розщеплюють ендоканабіноїди (наприклад, FAAH), призводить до анальгезії. У клінічних дослідженнях подібні ефекти спостерігалися у пацієнтів із фіброміалгією, мігренню, синдромом подразненого кишечника, де традиційна анальгетична терапія виявлялася неефективною, а модулювання ендоканабіноїдної активності призводило до покращення стану.
Щодо регуляції настрою, ендоканабіноїдна система виступає інтегрувальним механізмом між системами дофаміну, серотоніну, норадреналіну та ГАМК. CB1-рецептори в мезолімбічному дофаміновому шляху (особливо у вентральній тегментальній ділянці та nucleus accumbens) регулюють ендогенну дофамінову активність, яка критично впливає на емоційну мотивацію та відчуття задоволення. При низькому рівні ендоканабіноїдної активності порушується здатність відчувати позитивні емоції (ангедонія), а також зростає сприйнятливість до стресу.
У дорсальному рафе ядра серотонінергічної системи CB1-рецептори модулюють вивільнення серотоніну, причому залежно від умов можуть як посилювати, так і пригнічувати цю активність. Це дає пояснення, чому ендоканабіноїдна система впливає на обидва полюси афективних порушень – як депресивні стани, так і тривожні розлади. За даними нейровізуалізаційних досліджень, у пацієнтів із депресією спостерігається знижена експресія CB1-рецепторів у префронтальній корі, гіпокампі та скупченні базальних гангліїв, що супроводжується зменшенням тонічної ендоканабіноїдної активності.
Підвищення анандаміду або 2-AG у таких пацієнтів призводить до нормалізації нейропластичності, зниження запалення в центральній нервовій системі та відновлення регуляції стресової відповіді. Такі ефекти досягаються або прямим впливом на CB1-рецептори, або шляхом інгібіції ферментів розщеплення ендоканабіноїдів. При тривожних розладах, навпаки, гіперактивність певних зон (зокрема, мигдалика) може бути контрольована посиленням локального ендоканабіноїдного тонусу.
Механізми впливу на апетит і харчову поведінку реалізуються через гіпоталамус – центральну інтегративну зону, що координує енергетичний баланс. CB1-рецептори, розташовані в аркуатному ядрі, регулюють активність нейронів, які синтезують нейропептид Y (NPY) та агуті-подібний пептид (AgRP) – ключові модулятори голоду. Активація CB1-рецепторів стимулює ці нейрони, викликаючи відчуття голоду навіть при наявності достатнього енергетичного забезпечення, що пояснює ефект “гострого апетиту” після споживання канабіноїдів.
На противагу цьому, в умовах енергетичного дефіциту, система також підтримує бажання їжі, посилюючи відчуття задоволення від їжі через вплив на дофамінергічні шляхи. Це дозволяє організму адаптуватися до обмежених ресурсів і забезпечити виживання. Проте при хронічному зловживанні жирною, солодкою або калорійною їжею надмірна стимуляція CB1-рецепторів сприяє розвитку ожиріння і метаболічного синдрому.
У периферичних тканинах, включаючи печінку, підшлункову залозу, кишківник і жирову тканину, ендоканабіноїдна система також регулює метаболічні реакції: впливає на синтез інсуліну, секрецію лептину, чутливість до глюкози та ліполіз. При цьому її надмірна активність асоціюється з розвитком інсулінорезистентності, а її пригнічення – з поліпшенням чутливості до інсуліну.
Ендоканабіноїдна система людини координує тонку регуляцію болю, настрою та апетиту через складну взаємодію центральних та периферичних рецепторів, ендогенних лігандів та сигнальних шляхів. Її модуляція забезпечує адаптивну відповідь на зміну внутрішнього стану та зовнішнього середовища, а також бере участь у корекції патологічних станів, де ці процеси порушені. Завдяки цим властивостям вона є перспективною мішенню для фармакологічних інтервенцій у клінічній медицині.
Вплив на сон, імунну відповідь, терморегуляцію
Ендоканабіноїдна система бере участь у регуляції багатьох ключових фізіологічних процесів, серед яких контроль циклу сну, функціонування імунної системи та підтримання стабільної температури тіла. Її активність проявляється в контекстно-залежній модуляції різних нейрональних, гормональних та імунних ланцюгів, що дає змогу адаптувати організм до змін середовища або внутрішніх фізіологічних станів.
У регуляції сну основна роль належить CB1-рецепторам, які експресуються в гіпоталамічних структурах, таламусі, стовбурі мозку та корі. Їх активація змінює структуру сну, зокрема, збільшує тривалість повільнохвильового сну (SWS) і зменшує фази пробудження. Дослідження на тваринних моделях показали, що інгібіція ферментів FAAH або MAGL, які розщеплюють анандамід і 2-AG відповідно, веде до збільшення концентрації цих ендоканабіноїдів і, як наслідок, до подовження загального часу сну. Механізм реалізується через гальмування активності арей, відповідальних за підтримку неспання, таких як locus coeruleus і ретикулярна формація, а також через опосередкований вплив на секрецію мелатоніну в шишкоподібному тілі.
Експерименти з блокаторами CB1-рецепторів (наприклад, рімонабант) демонструють, що їх деактивація призводить до фрагментації сну, частого пробудження та порушення циркадного ритму. Ендоканабіноїдна система також регулює фазу швидкого сну (REM): у стані дефіциту анандаміду спостерігається скорочення цієї фази, що асоціюється з порушенням когнітивної консолідації пам’яті. У людських дослідженнях виявлено, що концентрації анандаміду в цереброспінальній рідині змінюються залежно від часу доби, досягаючи піку перед засинанням, що свідчить про участь системи в регуляції добових коливань в нейронній активності.
Щодо імунної відповіді, вплив ендоканабіноїдної системи реалізується переважно через CB2-рецептори, які експресуються в лімфоцитах, макрофагах, дендритних клітинах, мікроглії та інших імунокомпетентних структурах. Активація цих рецепторів веде до пригнічення вивільнення прозапальних цитокінів, таких як TNF-α, IL-1β, IL-6, одночасно посилюючи секрецію протизапальних агентів, зокрема IL-10. Це дозволяє системі діяти як імуномодулятор, забезпечуючи зниження надмірної імунної реакції, але не пригнічуючи захисну функцію повністю.
У разі автоімунних розладів – таких як розсіяний склероз, ревматоїдний артрит, хвороба Крона – ендоканабіноїдна активність має терапевтичний потенціал. У дослідженнях in vivo зафіксовано зменшення інфільтрації Т-клітин у тканини-мішені при посиленій активації CB2-рецепторів. Механізм дії полягає не лише у зменшенні запалення, але й у зміні фенотипу клітин із прозапального (M1-макрофаги) на регуляторний (M2-макрофаги), що сприяє відновленню пошкоджених тканин. CB1-рецептори, хоча й менш виражені в імунній системі, також беруть участь у модифікації нейроімунних взаємодій через мікроглію в ЦНС.
Під час інфекцій ендоканабіноїдна система регулює баланс між активним протибактеріальним захистом і мінімізацією ушкодження власних тканин. Наприклад, при сепсисі активація CB2-рецепторів зменшує летальність, знижуючи рівень системного запалення, однак при надмірному пригніченні імунної реакції може підвищитися ризик персистенції збудника, що вимагає тонкої регуляції.
Щодо терморегуляції, ендоканабіноїдна система бере участь у підтриманні температурного гомеостазу через центральні структури гіпоталамуса. В зонах преоптичної ділянки переднього гіпоталамуса CB1-рецептори впливають на нейрони, що контролюють вегетативні реакції, такі як вазоконстрикція, потовиділення і м’язове тремтіння. Активація цих рецепторів призводить до зниження температури тіла через зменшення симпатичної активності та посилення тепловіддачі.
Експериментально підтверджено, що анандамід викликає дозозалежне зниження температури у тварин при введенні в мозкові шлуночки, причому цей ефект блокується антагоністами CB1. Водночас при системному впливі температурна відповідь залежить від дозування, зовнішніх умов і початкового фізіологічного стану. У випадках гіпотермії ендоканабіноїдна система сприяє обмеженню теплових втрат, а при гіпертермії – активує охолоджуючі механізми. Це дає підстави вважати її компонентом внутрішнього “термостату”, який забезпечує швидке та динамічне реагування на зміну температурного балансу.
Взаємодія ендоканабіноїдної системи з іншими нейромедіаторними осями, зокрема серотоніновою, гістаміновою та норадреналіновою, дозволяє їй координувати терморегуляторні реакції не ізольовано, а в рамках загального гомеостатичного контексту. У клінічній практиці ці властивості потенційно застосовуються при лікуванні гарячкових станів, порушень терморегуляції при нейродегенеративних захворюваннях та після черепно-мозкових травм.
Ендоканабіноїдна система і яка її роль у контексті сну, імунної реакції та терморегуляції – це не лише структурна мережа рецепторів і лігандів, а повноцінна інтегративна система, що координує нейроендокринні, імунні та вегетативні реакції з високим ступенем адаптаційної точності.
Зв’язок з іншими системами організму: нервовою, гормональною
Ендоканабіноїдна система тісно інтегрована з провідними регуляторними системами організму – передусім нервовою та ендокринною. Її роль полягає не лише у модуляції локальних фізіологічних процесів, а й у координації міжсистемної взаємодії, що забезпечує адаптивні відповіді на внутрішні й зовнішні впливи. Цей функціональний перетин реалізується завдяки щільному розташуванню рецепторів CB1 у структурах центральної нервової системи та експресії CB1/CB2 у регуляторних вузлах ендокринної осі.
У нервовій системі ендоканабіноїдні сигнали виконують функцію ретроградних нейромедіаторів. Вони синтезуються “на вимогу” в постсинаптичних нейронах і діють на пресинаптичні CB1-рецептори, тимчасово знижуючи вивільнення нейромедіаторів – глутамату, ГАМК, ацетилхоліну, норадреналіну. Це створює короткочасні фази інгібування передачі, що дозволяє нейрональним мережам уникати гіперактивності або надмірного збудження. Найбільша щільність CB1 спостерігається в гіпокампі, базальних гангліях, амігдалі, префронтальній корі та мозочку – зонах, відповідальних за пам’ять, емоції, виконавчі функції, координацію рухів.
Цей механізм відіграє ключову роль у формуванні нейропластичності, де ендоканабіноїдні медіатори беруть участь у довготривалій депресії синаптичної передачі (LTD), впливаючи на процеси навчання і формування поведінкових патернів. У зоні мезолімбічного дофамінового шляху система модуляції через CB1 регулює вивільнення дофаміну з вентральної тегментальної ділянки в nucleus accumbens, що прямо пов’язано з мотивацією, нагородою, звичками. Це пояснює, зокрема, участь ендоканабіноїдної системи у механізмах залежностей та розладів афективного спектру.
З боку гормональної системи взаємодія найбільш чітко проявляється в межах гіпоталамо-гіпофізарно-наднирникової осі (HPA-осі). CB1-рецептори присутні в паравентрикулярному ядрі гіпоталамуса, де вони пригнічують вивільнення кортикотропін-рилізинг-гормону (CRH), що в результаті знижує секрецію АКТГ з гіпофіза і кортизолу з наднирників. Таким чином, ендоканабіноїдна система виступає природним обмежувачем стресової відповіді, запобігаючи її надмірній активації.
У стані хронічного стресу знижується експресія CB1 у гіпоталамічних і гіпофізарних структурах, що веде до підвищеного рівня циркулюючого кортизолу. В експериментальних умовах підвищення рівня анандаміду або блокада його деградації призводять до нормалізації HPA-активації. Окрім глюкокортикоїдної осі, ендоканабіноїди регулюють функцію щитоподібної залози, статевих залоз і панкреаса, впливаючи на виділення Т3/Т4, тестостерону, інсуліну та лептину.
Ще один важливий вектор перехрестя – це взаємодія з осередками регуляції репродуктивної функції. CB1-рецептори наявні в гіпоталамусі та гіпофізі, де вони впливають на секрецію гонадотропін-рилізинг-гормону (GnRH), лютеїнізуючого гормону (LH) і фолікулостимулюючого гормону (FSH). У жінок надлишкова активація CB1 пов’язана з порушенням овуляторного циклу, зменшенням секреції естрогену, а в чоловіків – зі зниженням сперматогенезу. Це підтверджує участь ендоканабіноїдної системи у складній регуляції фертильності через гормональні механізми.
Окремо варто зазначити роль системи у периферичних гормональних механізмах – особливо у жировій тканині. CB1-рецептори впливають на адипогенез, експресію лептину, резистину, а також інсулінову чутливість. Висока активність CB1 асоціюється з розвитком метаболічного синдрому – ожиріння, інсулінорезистентності, гіпертензії. Фармакологічне блокування CB1 покращує глікемічний контроль і сприяє зменшенню маси тіла, що було підтверджено низкою клінічних досліджень до припинення застосування рімонабанту через психіатричні побічні ефекти.
Інтегративна функція, яку виконує ендоканабіноїдна система людини, у межах нервової та гормональної систем, забезпечує складну зворотну координацію між афективним станом, нейронною збудливістю, ендокринною відповіддю та поведінковими патернами. Ця багаторівнева взаємодія дає змогу не лише адаптуватися до короткочасного впливу факторів довкілля, а й формувати довготривалі реакції, що змінюють нейроендокринний гомеостаз в умовах стресу, хвороби чи метаболічного навантаження.
Дефіцит ендоканабіноїдної системи
Злагоджене функціонування ендоканабіноїдної системи є критично важливим для підтримання фізіологічної рівноваги, адаптації до стресу та регуляції численних внутрішніх процесів. Проте останні десятиліття наукових досліджень показали, що її порушення може мати системний характер, викликаючи так званий функціональний або клінічний дефіцит. Це поняття не зводиться до простої відсутності рецепторів чи медіаторів, а охоплює широкий спектр дисфункцій, що впливають на регуляторні контури організму на нейрональному, ендокринному, імунному й метаболічному рівнях.
Дефіцит може проявлятися у зменшеній активності CB1 або CB2 рецепторів, зниженні синтезу ключових ендоканабіноїдів – анандаміду (AEA) та 2-арахідоноїлгліцеролу (2-AG), або у надмірній активності ферментів, що їх руйнують, передусім FAAH і MAGL. Порушення балансу між продукцією та деградацією цих сигнальних молекул призводить до зниження здатності системи адаптувати реакції організму на біль, запалення, стрес, коливання настрою, порушення сну й обміну речовин. Оскільки ендоканабіноїдна система охоплює як центральну, так і периферичну регуляцію, її зниження викликає одночасно психоемоційні й соматичні симптоми.
Гіпотетична модель клінічного дефіциту була вперше сформульована у 2001 році неврологом Етаном Руссо. Він запропонував об’єднати низку функціональних розладів, що не мають чіткої етіології, але демонструють спільні патофізіологічні риси – до них відносять мігрень, синдром подразненого кишківника (СПК), фіброміалгію, хронічну втому, деякі форми тривожних та депресивних розладів. Подальші дослідження підтвердили зниження рівнів анандаміду в лікворі пацієнтів із хронічним болем і тривожністю, а також зміни в експресії CB1-рецепторів у структурах мозку у хворих із депресивними розладами.
Механізми розвитку дефіциту можуть бути як первинними (генетичними), так і вторинними – тобто набутими внаслідок хронічного стресу, нейрозапалення, інфекцій, токсичних уражень, тривалого недосипання або порушень харчування. Також значну роль відіграють гормональні фактори, оскільки рівень ендоканабіноїдів змінюється залежно від циклічних коливань статевих гормонів, кортизолу, інсуліну та лептину. У жінок, зокрема, виявлено коливання тонусу ендоканабіноїдної системи протягом менструального циклу, що потенційно пояснює зміну порогу болю, настрою та апетиту в різні фази.
Патофізіологічно дефіцитна активність цієї системи призводить до надмірного збудження нейрональних контурів, нестабільності гіпоталамічних регуляторів, ослаблення протизапальних механізмів, порушення обробки больових сигналів і синаптичної адаптації. Це, своєю чергою, спричиняє гіперреактивність центральної нервової системи, порушення сну, зниження стресової толерантності, а також підвищену чутливість до подразників. Системне зниження ендоканабіноїдного тонусу створює умови для хронічного субклінічного запалення, що має значення у прогресії метаболічного синдрому, атеросклерозу та нейродегенеративних захворювань.
У структурі імунної відповіді дефіцит проявляється у зниженні модуляторного впливу CB2-рецепторів на макрофаги, мікроглію та Т-клітини, що призводить до переважання прозапальних цитокінів – ІЛ-1β, TNF-α, ІЛ-6. Це сприяє розвитку автоімунних та алергічних реакцій, нестабільності імунологічного толерансу, особливо на тлі хронічних подразників.
В контексті психіатричних станів недостатня робота ендоканабіноїдної системи корелює зі зниженням дофамінергічної активності, порушенням вироблення серотоніну та гальмуванням адаптаційної функції HPA-осі. Це сприяє розвитку депресивної симптоматики, тривожності, емоційної лабільності та розладів сну. За таких умов мозок втрачає здатність адекватно обробляти як емоційні, так і сенсорні сигнали, що збільшує суб’єктивне відчуття дискомфорту й болю без реального фізіологічного джерела.
Що таке клінічний дефіцит ЕКС
Клінічний дефіцит ендоканабіноїдної системи (ЕКС) – це концепція, що описує порушення внутрішньої регуляторної системи організму, яка зазвичай відповідає за підтримку фізіологічної рівноваги. Її суть полягає не лише у кількісному зниженні активних сполук, а у більш складних збоях у сигнальних шляхах, що охоплюють синтез, вивільнення, транспортування, зв’язування та деградацію ендогенних канабіноїдів і пов’язаних рецепторів. У результаті таких змін виникає стан, коли система втрачає здатність належним чином регулювати ключові функції – від передачі больових сигналів до емоційного гомеостазу.
У медичному та нейробіологічному дискурсі поняття клінічного дефіциту ЕКС вперше було введено для пояснення симптомів захворювань, які не мали чіткої етіології, проте демонстрували спільні ознаки: хронічний біль, порушення сну, гіперчутливість до сенсорних подразників, знижену толерантність до стресу та нестабільний емоційний фон. Одним із перших прикладів таких станів стали мігрень, фіброміалгія, синдром подразненого кишківника (СПК), а згодом і поствірусні синдроми, нейропатії невідомої природи, деякі психічні розлади.
У клінічній практиці спостерігається, що частина пацієнтів із вищезазначеними діагнозами не відповідає на стандартні схеми лікування – анальгетики, протизапальні засоби, антидепресанти чи анксіолітики. Це наштовхує на думку, що первинна проблема може полягати не в ураженні кінцевих структур, а в системному розбалансуванні модулювального механізму, яким є ЕКС. Відомо, що ендоканабіноїди виконують функцію ретроґрадних месенджерів – вони синтезуються “на вимогу” у постсинаптичних нейронах і зворотно впливають на пресинаптичне вивільнення нейромедіаторів. Якщо цей зворотний контроль порушений, виникає надмірна активність або пригнічення нейрональних контурів, що призводить до симптомів, котрі не вкладаються у класичні нозології.
Механістично клінічний дефіцит ЕКС може бути зумовлений рядом біохімічних відхилень. Наприклад, при вивченні ліквору у пацієнтів із хронічним болем і посттравматичним стресовим розладом виявляють знижені рівні анандаміду. Інші дані свідчать про змінену експресію CB1-рецепторів у префронтальній корі у випадках депресивних станів. Зниження щільності рецепторів CB1 у ділянках, відповідальних за регуляцію емоцій та реакцію на стрес, веде до неадекватної обробки афективної інформації та нестабільної взаємодії між мозковими мережами. Додатково, збільшення активності ферменту FAAH, що руйнує анандамід, було пов’язане з тривожними розладами, особливо в експериментах на моделях гризунів, де генетичне зниження активності FAAH сприяло зменшенню поведінкової тривоги.
Не менш важливою складовою є порушення взаємодії між ЕКС та іншими системами – серотонінергічною, дофамінергічною, HPA-віссю (гіпоталамус-гіпофіз-наднирники), а також імунною мережею. Оскільки канабіноїди впливають на гомеостатичні реакції, недостатність регуляторного контролю з їх боку сприяє хронічному запаленню низького ступеня, що сьогодні розглядається як одна з ключових рушійних сил для великого спектра хвороб – від нейродегенеративних процесів до порушень метаболізму.
Феномен клінічного дефіциту ЕКС не зводиться лише до гострого чи хронічного зниження ендоканабіноїдної активності. Це – динамічна дисфункція, що змінюється залежно від середовища, віку, гормонального статусу, впливу токсинів, психоемоційних факторів і навіть мікробіоти кишківника. Дослідження останніх років активно розглядають мікробіом як компонент, що опосередковано впливає на ЕКС, зокрема через синтез жирних кислот і коротколанцюгових метаболітів, які можуть модулювати CB1/CB2-рецептори або активність синтаз і гідролаз.
З клінічної точки зору діагностика такого стану залишається складною. Відсутність стандартизованих біомаркерів або референтних значень рівня анандаміду чи 2-AG в крові чи тканинах унеможливлює постановку точного діагнозу. Оцінка проводиться переважно методом виключення, за наявності типових симптомів, стійких до класичного лікування, і супутніх ознак зниження нейропластичності, психоемоційної адаптації, порушення сну, втоми й хронічного болю.
Ключовою особливістю стану, що дозволяє відмежувати його від інших патологій, є поліорганна, багатосимптомна природа проявів за відсутності морфологічних уражень. Це – функціональний розлад, у якому інструментальні методи не дають специфічної картини, але якість життя пацієнта суттєво страждає.
У цьому контексті дефіцит ендоканабіноїдної системи розглядається як своєрідна “фоново-причинна” ланка, яка не є діагнозом у класичному розумінні, але виступає концептуальною рамкою для об’єднання низки незрозумілих, але клінічно реальних станів. Саме тому все більше дослідників і клініцистів визнають доцільність застосування персоналізованих стратегій терапії, що передбачають модифікацію активності ЕКС – через фармакологічні, дієтичні, поведінкові та фітотерапевтичні підходи.
Симптоми та захворювання, пов’язані з дефіцитом
Порушення ендоканабіноїдного тонусу проявляється як багатовекторна дисфункція, що зачіпає кілька систем організму одночасно. В клінічній практиці це призводить до наявності симптомів, які не вписуються в єдину діагностичну категорію, але утворюють стійкий симптомокомплекс, характерний для дефіциту ендоканабіноїдної регуляції.
Першочергово проявляються симптоми з боку ноцицептивної системи. Характерним є хронічний, поширений біль без чіткої локалізації, який не супроводжується структурними ураженнями тканин. Це особливо помітно у фіброміалгії – стані, де біль носить м’язово-скелетний характер, а лабораторні показники залишаються в межах норми. У пацієнтів із фіброміалгією спостерігається зниження порогу болю, гіпералгезія та алодинія, що свідчить про порушення центральної модуляції больових сигналів.
Іншим ключовим симптомом є циклічні головні болі, зокрема мігрень. Її особливість полягає у взаємодії судинного компонента з нейрозапальним. У пацієнтів з мігренню фіксують порушення ендоканабіноїдного метаболізму, що виявляється у зниженні рівнів анандаміду в плазмі. Це спричиняє недостатнє пригнічення тригемінальної активності та надмірне вивільнення прозапальних нейропептидів.
Серед гастроентерологічних станів особливо часто виявляється синдром подразненого кишківника (СПК). Для нього характерні змінні порушення моторики кишечника, чергування діареї та запору, а також хронічний біль у животі. ЕКС у нормі забезпечує тонке регулювання кишкової моторики та бар’єрної функції. Її дефіцит призводить до дизбалансу між симпатичним і парасимпатичним контролем, що проявляється вегетативною нестабільністю та гіперреактивністю ентеричної нервової системи.
Інтегративним проявом порушення ендоканабіноїдної активності є поєднання тривоги, депресії та розладів сну. Низький ендоканабіноїдний тонус пов’язаний із гіперактивністю гіпоталамо-гіпофізарно-наднирникової осі та нестачею зворотного гальмування стресової відповіді. Це викликає стійке відчуття внутрішньої напруги, погіршення здатності до емоційного саморегулювання, тривожні думки, соматизовані симптоми без чіткої органної локалізації.
Часто реєструється хронічна втома – непояснене виснаження, яке не минає після відпочинку, супроводжується когнітивними порушеннями (так званий “мозковий туман”) і фізичною слабкістю. Ці симптоми спостерігаються при міалгічному енцефаломієліті, який деякі автори також пов’язують із дисрегуляцією ЕКС.
З боку імунної системи спостерігається схильність до надмірної запальної відповіді, що виявляється у постійній присутності системного запалення низького рівня. Це не супроводжується гострою лихоманкою або класичними запальними маркерами, проте проявляється стійким підвищенням рівня прозапальних цитокінів. Згодом такий стан може стати базою для розвитку аутоімунних процесів або вторинного імунодефіциту, в залежності від індивідуальних реакцій організму.
У сфері репродуктивного здоров’я відзначаються порушення менструального циклу, ендометріозоподібні болі та зниження фертильності. Канабіноїди беруть участь у регуляції гонадотропінів і локальних процесів у яєчниках та матці. Їхній дефіцит може викликати дизбаланс статевих гормонів, а також підвищену чутливість до циклічних гормональних змін.
У кардіоваскулярній системі при хронічному дефіциті ЕКС реєструються епізоди тахікардії, нестабільність артеріального тиску, схильність до вазоспастичних реакцій. Це обумовлено порушенням автономного контролю тонусу судин. Канабіноїди у фізіологічних умовах беруть участь у регуляції вазодилатації й скорочення, тому їх недостатність порушує динамічну рівновагу в гемодинаміці.
Симптоми з боку сечовидільної системи включають хронічні тазові болі, імперативні позиви до сечовипускання, нестабільність детрузора, що не має морфологічного субстрату. Це характерно для синдрому болісного сечового міхура, який деякі дослідники вважають канабіноїд-чутливою патологією.
У контексті нейропсихіатрії особливе місце займає синдром дефіциту уваги та гіперактивності (СДУГ) у дорослих, що супроводжується імпульсивністю, зниженням концентрації, емоційною нестабільністю. Теоретичною основою для його зв’язку з ЕКС є участь канабіноїдів у префронтальній регуляції уваги й реактивності.
Серед шкірних проявів зафіксовано асоціації між дефіцитом ЕКС та такими станами, як атопічний дерматит, псоріаз, себорейний дерматит. Канабіноїдні рецептори виявлено у кератиноцитах, меланоцитах і волосяних фолікулах, де вони беруть участь у регуляції проліферації, запальної відповіді та секреції шкірного сала. Їх дисфункція веде до гіперреактивності шкіри на зовнішні подразники.
Необхідно враховувати, що ендоканабіноїдна система людини не функціонує ізольовано. Більшість симптомів виникає внаслідок порушеної взаємодії між ЕКС та іншими регуляторними мережами, особливо при стресі, гормональних зрушеннях чи системних навантаженнях. Виснаження ендоканабіноїдного резерву, накопичення метаболічних порушень, дефіцит сну й хронічний психоемоційний тиск ведуть до закріплення патологічної картини, яка без цілеспрямованого втручання не має тенденції до спонтанного зникнення.
Особливої уваги заслуговує постінфекційний та поствірусний синдром, що характеризується поєднанням когорти симптомів: зниженням когнітивної продуктивності, порушенням сну, хронічною втомою, болем у м’язах і суглобах, погіршенням терморегуляції. У цих станах передбачається вторинне виснаження ендоканабіноїдного потенціалу після перенесеної інфекції з високим рівнем запального навантаження.
Сучасні підходи до корекції (терапія, зміни способу життя)
Після визнання клінічного дефіциту ендоканабіноїдної системи як окремого функціонального порушення, інтерес до можливих способів його корекції зростає. Комплексна стратегія передбачає використання фармакологічних засобів, нутрицевтичних підходів, регуляцію режиму сну, фізичну активність і модифікацію психоемоційного навантаження. Усі ці втручання мають на меті не лише стимуляцію ендоканабіноїдної активності, а й стабілізацію метаболічного фону, на якому ця система функціонує.
Фармакологічна терапія базується на двох ключових напрямках: пряма стимуляція канабіноїдних рецепторів або інгібування ферментів, що руйнують ендоканабіноїди. У першому випадку застосовуються синтетичні або фітоканабіноїди, які імітують дію ендогенних лігандів. Найбільш вивченим представником є дельта-9-тетрагідроканабінол (THC), який має високу спорідненість до CB1-рецепторів. Його дія дозволяє тимчасово компенсувати дефіцит ендогенної сигнальної активності. Однак використання THC обмежується побічними ефектами, зокрема психоактивністю, толерантністю та ризиком дисфоричних реакцій при тривалому прийомі.
Альтернативою є канабідіол (CBD) – непсихоактивна молекула, що впливає на ЕКС непрямо. Вона модулює активність рецепторів TRPV1, GPR55, а також змінює концентрації ендогенних канабіноїдів шляхом інгібування зворотного захоплення анандаміду. У клінічних дослідженнях CBD демонструє ефективність при тривожних розладах, епілепсії, хронічному болю, що побічно вказує на здатність регулювати ендоканабіноїдний гомеостаз. Застосування CBD у формі стандартизованих екстрактів або ізолятів вимагає точного дозування, оскільки ефективність залежить від індивідуальної чутливості та супутньої патології.
Другий напрям – це інгібування ферментів, що відповідають за деградацію ендоканабіноїдів. Найбільш відомий фермент FAAH, що розщеплює анандамід. Його фармакологічне блокування дозволяє збільшити концентрацію ендогенних лігандів у синаптичній щілині, посилюючи фізіологічну активацію рецепторів. Препарати цієї групи ще проходять клінічну апробацію, однак попередні результати свідчать про їх перспективність для лікування болю, тривожності та посттравматичних розладів.
Позапатентовані засоби, що потенційно впливають на ендоканабіноїдний тонус, включають препарати омега-3-жирних кислот, магнію, куркуміну, піперину, катехінів зеленого чаю. Ці речовини впливають на активність ферментів, експресію рецепторів або рівень прозапальних медіаторів, що опосередковано покращує роботу ендоканабіноїдної системи. Омега-3, наприклад, необхідні для біосинтезу ендоканабіноїдів із правильним структурним співвідношенням. Куркумін і піперин мають здатність знижувати експресію FAAH, а також впливати на прозапальні каскади, що пригнічують ендоканабіноїдну активність.
Фізична активність – один із найбільш ефективних фізіологічних тригерів для стимуляції ендоканабіноїдів. Аеробні навантаження середньої інтенсивності сприяють підвищенню рівнів анандаміду й 2-AG у плазмі, що, в свою чергу, покращує настрій, знижує больове сприйняття та зменшує рівень тривожності. Важливим є регулярність: щоденні або мінімум 3-4 рази на тиждень заняття тривалістю від 30 хвилин забезпечують кумулятивний ефект. Серед оптимальних видів навантажень – плавання, швидка хода, помірний біг, танці або велосипед. Високоінтенсивні тренування також стимулюють ЕКС, але при надмірному навантаженні можливе виснаження системи через посилений стрес-відгук.
Сон регулює оновлення рецепторного поля та балансування між CB1 і CB2-активністю. Дефіцит глибокого сну призводить до зниження чутливості до ендогенних канабіноїдів та зменшення їх секреції. Нормалізація циркадних ритмів – ключовий компонент стабілізації ЕКС. Для цього доцільно регулювати час засинання і пробудження, уникати синього світла ввечері, не використовувати електронні пристрої перед сном і підтримувати сталу температуру в спальні. Мелатонін у низьких дозах або екстракти валеріани можуть застосовуватись як тимчасова підтримка для переходу до більш глибоких фаз сну, але не повинні замінювати повноцінні гігієнічні звички.
Психоемоційний стан є ще одним фактором, що критично впливає на тонус ЕКС. Хронічний стрес, емоційне виснаження, інформаційне перевантаження – всі ці чинники призводять до дезорганізації канабіноїдної сигналізації через гіперактивацію кортизольної осі. Техніки свідомого розслаблення, як-от глибоке дихання, медитація, тілесно-орієнтовані практики (наприклад, йога або цигун), показали здатність підвищувати активність CB1-рецепторів та нормалізувати взаємодію між гіпокампом і префронтальною корою. Короткотривалі інтервенції можуть давати ефект уже після 10-15 хвилин щоденної практики, а системне впровадження зменшує симптоми тривоги, гіпервозбудливості й соматизації.
Раціон відіграє фундаментальну роль у підтримці ендоканабіноїдного балансу. Надмірне споживання омега-6 жирних кислот на фоні дефіциту омега-3 сприяє утворенню неактивних або навіть антагоністичних метаболітів, що витісняють ендоканабіноїди з рецепторів. Продукти з високим вмістом трансжирів, глутамату натрію, консервантів або простих цукрів пригнічують нейромедіаторну пластичність і метаболізм ліпідів. Рекомендованим є збільшення частки рослинної їжі з високим вмістом поліфенолів, жирної морської риби, насіння льону, горіхів і зниження вживання промислово оброблених продуктів. Окрему увагу варто приділити мікробіоті кишечника, адже коротколанцюгові жирні кислоти, які утворюються під час ферментації харчових волокон, здатні модулювати канабіноїдну сигналізацію через ентероендокринні клітини.
Експериментальні підходи включають застосування адаптогенів (родіола, ашваганда), а також селективну стимуляцію певних типів рецепторів з використанням агоністів нових поколінь. У клінічній фармакології досліджується комбінація низьких доз фітоканабіноїдів із модуляторами серотонінових, опіоїдних або дофамінових рецепторів – такий мультирецепторний вплив має потенціал для індивідуалізованої терапії.
Інтеграція цих підходів вимагає індивідуального підбору та динамічного моніторингу. Важливо не лише збільшити ендоканабіноїдну активність, але й створити умови для її стійкої стабілізації без виснаження. Рівень ефективності залежить від комбінації методів, їх взаємної підтримки й здатності організму адаптуватись до нових умов регуляції. Системний підхід, що поєднує фармакологію, спосіб життя та поведінкові втручання, є оптимальним шляхом до відновлення функціонального балансу при ендоканабіноїдному дефіциті.
Ендоканабіноїдна система та канабіс
Упродовж останніх десятиліть канабіс з об’єкта криміналізованої політики перетворився на центр уваги фармакології, нейронаук і клінічної медицини. Сучасна наука дедалі глибше розкриває складну і багатовекторну взаємодію біологічно активних сполук цієї рослини з ендоканабіноїдною системою організму людини. Саме вивчення механізмів дії фітоканабіноїдів, зокрема Δ9-тетрагідроканабінолу (ТГК) і канабідіолу (КБД), дозволило окреслити ключові контури ендоканабіноїдної регуляції, що раніше залишалася поза межами медичного знання.
Канабіс впливає на центральну і периферичну нервову систему через взаємодію з двома основними рецепторними підтипами – CB1 та CB2, які є частиною ендоканабіноїдного комплексу. CB1-рецептори переважно локалізуються в головному мозку, зокрема в гіпокампі, базальних гангліях, мозочку та префронтальній корі, тоді як CB2-рецептори зосереджені в клітинах імунної системи, селезінці та периферичних тканинах. Ці рецептори спочатку були відкриті саме через спроби зрозуміти, через які рецептори канабіс взаємодіє з ендоканабіноїдною системою нашого організму, що свідчить про тісну історичну і функціональну взаємопов’язаність між природною біохімією людини й фітогенними лігандами.
Ключовим відкриттям стало усвідомлення того, що ендоканабіноїдна система не створена для обробки екзогенних канабіноїдів, але має власні ендогенні ліганди – анандамід і 2-AG – які виконують роль регуляторів внутрішньоклітинного сигналінгу. Канабіс лише мімікрує або модуляторно впливає на ці процеси, втручаючись у тонкий баланс гальмівних і збуджувальних сигналів. У цьому контексті важливо не спрощувати розуміння фітоканабіноїдів до ролі “заміни” для ендоканабіноїдів: дія канабісу є варіабельною, дозозалежною, рецепторно-специфічною і значною мірою контекстуальною – залежною від фізіологічного, психоемоційного і метаболічного стану індивіда.
Завдяки своїй ліпофільності ТГК легко проходить через гематоенцефалічний бар’єр і зв’язується з CB1-рецепторами, що веде до змін у вивільненні нейромедіаторів, включно з дофаміном, глутаматом, ГАМК, серотоніном. Це пояснює широкий спектр його ефектів: від ейфорії та сенсорної гіперчутливості до зміни часових оцінок, моторної координації та апетиту. КБД, навпаки, має низьку спорідненість до канабіноїдних рецепторів, але впливає на систему шляхом алостеричної модуляції, пригнічення зворотного захоплення анандаміду та зв’язування з низкою неканабіноїдних мішеней: TRPV1, PPARγ, 5-HT1A. Така взаємодія демонструє складну мережеву структуру впливу канабісу, що охоплює не лише ЕКС, а й численні суміжні сигнальні системи.
На основі цих механізмів було висунуто ідею, що контрольоване застосування фітоканабіноїдів може слугувати терапевтичним інструментом для компенсації або модуляції функцій ендоканабіноїдної системи. Зокрема, при гіпофункції ЕКС – наприклад, у разі клінічного дефіциту анандаміду – фітоканабіноїди можуть тимчасово відновлювати рецепторну активність і стабілізувати нейрофізіологічний гомеостаз. Проте одночасно з’являється питання ризиків: тривале стимулювання CB1-рецепторів може призвести до їх десенситизації, зниження експресії та функціонального виснаження системи. Це ставить виклик перед клінічною канабісотерапією: як досягти корекції без порушення довготривалої рецепторної рівноваги.
Ще одним важливим аспектом є те, що ефекти канабісу залежать не лише від ТГК чи КБД, а від так званого “ефекту ансамблю” – сукупної взаємодії всіх біоактивних компонентів рослини, включно з терпенами, флавоноїдами, індикаторами окисного статусу. Наприклад, терпени, які надають сорту аромату, здатні модуляторно впливати на проникність клітинних мембран і чутливість до лігандів. Це підсилює або пом’якшує ефекти основних канабіноїдів, створюючи складну динамічну картину дії.
Регіональні відмінності у генетиці рослини канабіс, методах культивації, технологіях екстракції також впливають на фармакологічний профіль. Медичні екстракти можуть містити різне співвідношення ТГК і КБД, що обумовлює спектр клінічного застосування – наприклад, при епілепсії, тривожності, хронічному болю чи розладах харчування. Водночас, рекреаційні продукти часто мають підвищений вміст ТГК, що збільшує ризик психіатричних ускладнень при відсутності клінічного моніторингу.
З наукової точки зору, канабіс є інструментом для моделювання, тестування й уточнення уявлень про внутрішні механізми людської регуляції. ЕКС – це не ізольована система, а інтегративна мережа, що переплітається з дофамінергічною, серотоніновою, глютаматною, ендогенно-опіоїдною сигналізацією. Через це вивчення ефектів канабісу дозволяє ідентифікувати невидимі раніше регуляторні вузли, перехрестя між фізіологією й суб’єктивним досвідом. У цьому сенсі ендоканабіноїдна система та канабіс стають не лише об’єктом прикладної медицини, а й ключем до міждисциплінарного розуміння цілісної нейрофізіології.
Не менш важливою є етична й соціальна площина питання. Поширення канабісу у вигляді легалізованих або медичних продуктів піднімає дискусію про межі саморегуляції, роль держави у контролі над психоактивними речовинами, а також рівень наукової грамотності серед користувачів. Наявність продукту на ринку ще не гарантує його безпечності чи ефективності для конкретного клінічного випадку. Безпека терапії потребує діагностичної оцінки, медичного нагляду, персоналізованого підбору форми й дози.
Взаємодія фітоканабіноїдів з ЕКС
Фітоканабіноїди – це група біологічно активних сполук рослинного походження, які виявляють спорідненість до рецепторів ендоканабіноїдної системи, імітуючи або модуляторно змінюючи дію ендогенних канабіноїдів. У рослині канабіс виявлено понад 100 таких речовин, проте найбільш вивченими є Δ9-тетрагідроканабінол (ТГК), канабідіол (КБД), канабігерол (КБГ), канабіхромен (КБХ) і канабінол (КНБ). Їхня взаємодія з рецепторними структурами організму не є уніфікованою – кожен фітоканабіноїд має унікальну фармакодинаміку, що визначається типом рецепторного зв’язування, алостеричним потенціалом, впливом на ензиматичну деградацію та транспорт ендогенних лігандів.
Основним рецептором, з яким фітоканабіноїди активно взаємодіють, є CB1 – центральний компонент нейрональної регуляції, представлений у глутаматергічних, ГАМК-ергічних, дофамінергічних і серотонінергічних структурах мозку. Δ9-ТГК діє як частковий агоніст CB1, активуючи його в дозозалежній манері. Це викликає пригнічення вивільнення нейромедіаторів через механізм ретроградної інгібіції, що реалізується шляхом впливу на кальцієві канали та внутрішньоклітинну передачу сигналу через Gi/o-білки. Такий механізм дозволяє змінювати синаптичну пластичність, що лежить в основі пам’яті, афективної реактивності, мотиваційного контролю. Проте ТГК не активує CB1 до максимуму його потенціалу, на відміну від деяких синтетичних канабіноїдів – ця особливість пояснює порівняно нижчу токсичність, але більшу варіативність відповіді.
На відміну від ТГК, КБД не має прямої агоністичної дії на CB1 або CB2. Його активність реалізується опосередковано: через алостеричне пригнічення CB1, інгібування FAAH (ферменту, що деградує анандамід), зв’язування з TRPV1, PPARγ та 5-HT1A. Таке багатовекторне втручання дозволяє КБД модуляторно впливати на системи, залучені до регуляції тривоги, ноцисепції, запалення, окисного стресу. Цікаво, що КБД здатен зменшувати психоактивні ефекти ТГК при одночасному вживанні, діючи як його функціональний антагоніст. Це зумовлено зміною доступності CB1 для ТГК та впливом на транспорт анандаміду, який конкурує з фітоканабіноїдами за рецепторне зв’язування.
Інші сполуки, такі як КБГ і КБХ, демонструють селективну активність до CB2-рецепторів або взаємодіють із TRP-каналами, не зачіпаючи безпосередньо класичні канабіноїдні шляхи. КБГ, зокрема, виступає як слабкий агоніст CB1 і помірний антагоніст 5-HT1A, а також інгібує зворотне захоплення норадреналіну. Такі властивості надають йому потенціалу як протизапальної, нейропротекторної і навіть антидепресивної молекули. КБХ, у свою чергу, проявляє протинабрякову й антиноцицептивну дію через активацію TRPA1, TRPV3 та CB2. Усі ці взаємодії мають складний часозалежний профіль, що включає не тільки пряме зв’язування, а й транскрипційні зміни в експресії рецепторів.
Особливої уваги заслуговує механізм взаємодії фітоканабіноїдів із CB2-рецепторами. Ці рецептори, які спочатку вважалися периферичними, тепер ідентифіковані й у мікроглії, астроцитах, нейронах стовбура мозку. CB2-медіація асоціюється із зниженням прозапальних цитокінів, інгібуванням клітинної міграції та стимуляцією апоптозу в імунних клітинах. Фітоканабіноїди, такі як КБГ і КБХ, а також окремі похідні ТГК, активують CB2 шляхом стабілізації конформації рецептора в антизапальній формі, що відкриває перспективи для використання їх у терапії хронічних запальних і нейродегенеративних станів без психоактивного ефекту.
Не менш важливою є взаємодія фітоканабіноїдів із системами ферментів і транспортерів. Так, ТГК і КБД можуть інгібувати FAAH і MAGL – ферменти, що відповідають за деградацію анандаміду та 2-AG відповідно. Це призводить до підвищення тонічного рівня ендоканабіноїдів, які, у свою чергу, впливають на CB1 і CB2. Таким чином, фітоканабіноїди не лише імітують дію ендогенних молекул, а й збільшують їхню біодоступність шляхом зниження катаболізму. Окрім цього, вплив на транспортні білки, зокрема FABP, змінює клітинну локалізацію анандаміду, що також модулює рецепторну активність.
Канабіноїди впливають і на ядерні рецептори, зокрема PPARγ, який контролює експресію генів, пов’язаних із запаленням, метаболізмом ліпідів, окислювальним стресом. КБД та КБГ активують PPARγ, викликаючи зміни у транскрипції генів, що забезпечують антиоксидантний захист і покращення інсулінової чутливості. Це відкриває можливості для застосування в терапії метаболічного синдрому, діабету II типу та нейродегенеративних захворювань.
Взаємодія фітоканабіноїдів не обмежується рецепторною дією. Терпеноїди, присутні у складі канабісу, підсилюють або змінюють фармакокінетику основних канабіноїдів, змінюючи проникність гематоенцефалічного бар’єра, модуляцію P450-ферментів печінки, і навіть чутливість рецепторів до лігандів. Наприклад, β-каріофілен діє як селективний агоніст CB2, а мірцен потенціює седативний ефект ТГК. Цей ансамбль, званий “ефектом оточення”, становить принципову відмінність дії природного канабісу від ізольованих канабіноїдів або синтетичних препаратів.
Інтенсивність, тривалість і специфіка ефектів фітоканабіноїдів значною мірою залежать від дозування, способу введення, біодоступності та індивідуальних варіацій у рецепторній експресії. Інтраіндивідуальна мінливість, зумовлена генетичними поліморфізмами, станом мікробіоти, бар’єрною проникністю та активністю метаболічних ферментів, впливає на суб’єктивну відповідь на однакову дозу. Це потребує персоналізованого підходу при терапевтичному застосуванні канабісу.
ТГК, КБД та інші активні сполуки рослини
Хімічний склад канабісу не обмежується лише канабіноїдами, проте саме вони є головними біоактивними речовинами, які впливають на фізіологію людини. Серед понад сотні канабіноїдів найкраще вивчені Δ9-тетрагідроканабінол (ТГК) і канабідіол (КБД), однак важливу роль також відіграють канабігерол (КБГ), канабінол (КНБ), канабіхромен (КБХ) і низка малих сполук, зокрема терпеноїди й флавоноїди. Усі ці компоненти діють у різних фармакологічних векторах і разом визначають широту біологічної дії канабісу.
ТГК – це психоактивний компонент канабісу, що проявляє високу спорідненість до CB1-рецепторів, розташованих переважно в головному мозку. Він є частковим агоністом цього рецептора, що дозволяє йому модулювати нейротрансмітерну активність, включаючи глутамат, ГАМК, дофамін і серотонін. Молекула ТГК ліпофільна, легко проходить через гематоенцефалічний бар’єр і має тривалий період напіввиведення. Її ефекти – ейфорія, зміни сприйняття, тимчасове зниження когнітивної гнучкості, посилення сенсорної інтеграції – є наслідком центральної нейромодуляції.
При тривалому використанні ТГК запускає низку компенсаторних змін у нейрональних мережах, включаючи зниження чутливості CB1-рецепторів (десенситизацію), зміну внутрішньоклітинних сигнальних каскадів (особливо через Gi/o-білки) і алостеричну реорганізацію мембранних доменів. Ці адаптації можуть змінювати ефективність ендогенних канабіноїдів і призводити до зміщення балансу між збудженням і гальмуванням у нейрональних ланцюгах. Такий механізм має значення при формуванні залежності та толерантності.
КБД – другий за популярністю, але не психоактивний канабіноїд. Він не діє напряму на CB1 або CB2, однак опосередковано впливає на активність обох через блокаду FAAH (ферменту, що руйнує анандамід), алостеричну модуляцію CB1, стимуляцію PPARγ, TRPV1 та 5-HT1A. Завдяки цьому КБД проявляє анксолітичну, протизапальну, протисудомну дію і стабілізує електричну активність мозку при епілепсії. Його ефект залежить від дози, індивідуальної фармакокінетики, а також присутності інших канабіноїдів.
КБД також модулює експресію генів через взаємодію з ядерними рецепторами, впливаючи на клітинну диференціацію, апоптоз, антиоксидантний захист. На відміну від ТГК, він не викликає десенситизації рецепторів і, навпаки, здатен відновлювати рецепторну чутливість до ендогенних лігандів у умовах їхнього дефіциту.
Канабігерол (КБГ) – попередник ТГК і КБД у біосинтетичному шляху. Його концентрація в зрілих рослинах невисока, проте він демонструє слабку активність на CB1 і CB2, а також взаємодіє з TRPA1, TRPM8, 5-HT1A. КБГ має нейропротекторні та антибактеріальні властивості, пригнічує агрегацію MRSA, модуляторно впливає на кишкову перистальтику та проявляє ефект при глаукомі за рахунок зниження внутрішньоочного тиску. У відмінність від ТГК, він не є психоактивним і не спричиняє толерантності.
Канабінол (КНБ) утворюється шляхом окиснення ТГК, особливо в старому або погано збереженому матеріалі. Його спорідненість до CB1 є слабкою, однак до CB2 – помірною. Він проявляє седативні властивості, протизапальний ефект і потенційно може бути корисним у терапії інсомнії та нейродегенеративних станів. КНБ впливає на процеси проліферації клітин, пригнічує вивільнення прозапальних цитокінів і має селективну активність у тканинах із підвищеним оксидативним стресом.
Канабіхромен (КБХ) – ще один непсихоактивний компонент, що проявляє протизапальну, антидепресивну і нейрогенну дію. Він активує TRPA1, CB2 і, частково, PPARγ. Експериментальні дані демонструють його здатність стимулювати нейрогенез у гіпокампі, що може бути використано в терапії депресії або нейровідновлення. В умовах комбінації з іншими канабіноїдами КБХ проявляє синергічний ефект, зокрема в анальгезії.
Крім канабіноїдів, канабіс містить понад 200 терпенів, які значною мірою впливають на біологічну дію рослини. Наприклад, β-каріофілен є селективним агоністом CB2, мірцен впливає на проникність клітинних мембран, ліналол модулює рецептори ГАМК. Взаємодія канабіноїдів з терпенами формує феномен так званого “ефекту оточення”, при якому дія суміші перевищує дію індивідуальних сполук.
До активних компонентів також належать флавоноїди, які мають антиоксидантні, нейропротекторні та протизапальні властивості. Наприклад, каннафлавін А пригнічує продукцію PGE2 – потужного медіатора запалення – в 30 разів ефективніше за аспірин. Хоча концентрація флавоноїдів у канабісі незначна, їхня участь у фармакологічному профілі рослини є суттєвою.
Важливо розуміти, що кожна з цих речовин має не лише власні ефекти, але й змінює фармакодинаміку інших компонентів. Наприклад, КБД може зменшувати психоактивний потенціал ТГК, тоді як КБГ підсилює його анальгезію. У клінічній практиці ця взаємодія набуває значення при розробці композиційних препаратів і підборі терапевтичного профілю для індивідуальних потреб.
Фармакокінетика фітоканабіноїдів залежить від способу введення. При інгаляційному вживанні ТГК досягає максимуму в плазмі через 5-10 хвилин, при пероральному – через 1,5-2 години. КБД має нижчу біодоступність, особливо при прийомі всередину, тому для досягнення терапевтичного ефекту часто потрібні вищі дози. Метаболізм відбувається переважно в печінці через систему цитохрому P450, з утворенням активних метаболітів, які самі можуть мати фармакологічну активність.
Реакція на канабіноїди індивідуально варіюється в залежності від генетичних поліморфізмів, метаболічного стану, наявності запалення, складу мікробіоти та загального стану ендоканабіноїдної системи та канабісу в організмі. Тому стандартизований підхід до дозування або вибору канабіноїдного профілю часто є неефективним.
Медичне використання канабісу та вплив на ЕКС
У клінічній практиці канабіс розглядається як багатокомпонентний фармакологічний інструмент, що впливає на широкий спектр патологічних процесів. Його застосування не обмежується лише симптоматичною терапією, а дедалі частіше включається в моделі патогенетичного втручання. Завдяки здатності канабіноїдів регулювати гомеостатичні механізми, медичний канабіс використовують у лікуванні хронічного болю, епілепсії, тривожних розладів, нудоти при хіміотерапії, м’язової спастичності при розсіяному склерозі, порушень сну та втрати апетиту при ВІЛ/СНІД.
Однією з найбільш валідованих галузей застосування є невропатичний біль, який слабо піддається дії традиційних анальгетиків. Канабіноїди модулюють передачу больових сигналів на рівні спинного мозку та таламуса, знижуючи активність проноцицептивних нейронів і водночас впливаючи на емоційне сприйняття болю через мезолімбічну систему. Комбінація ТГК і КБД в препаратах типу Sativex виявила ефективність у контролі хронічного болю у пацієнтів із онкологією, ревматоїдним артритом, фіброміалгією.
У лікуванні фармакорезистентної епілепсії, зокрема при синдромах Леннокса-Гасто та Драве, успішно застосовують очищений канабідіол. Препарат Epidiolex, зареєстрований FDA, показав зниження частоти нападів на 30-50% у більшості пацієнтів. Цей ефект пов’язують з дією КБД на іонні канали (особливо Na+ і Ca2+), рецептори TRPV1, 5-HT1A та з модуляцією синаптичної пластичності в зонах епілептогенезу. Важливо, що КБД не чинить психоактивної дії й має сприятливий профіль безпеки навіть у високих дозах.
М’язова спастичність при розсіяному склерозі – ще одна патологія, де канабіноїди продемонстрували клінічну користь. Зменшення тонусу м’язів, болю та поліпшення якості життя пацієнтів пов’язані з дією ТГК через CB1-рецептори у моторній корі та спинальному мозку. Дослідження показують зменшення спастичності у 40-50% пацієнтів, які не відповідали на інші препарати, при прийомі комбінованих екстрактів.
При онкологічних захворюваннях канабіс використовується не лише для контролю болю, а й для зменшення нудоти й блювання, викликаних хіміотерапією. Синтетичні канабіноїди, такі як дронабинол та набілон, схвалені для лікування хіміоіндукованої нудоти у пацієнтів, що не реагують на антагоністи 5-HT3. Крім того, канабіноїди можуть сприяти стабілізації маси тіла через стимуляцію апетиту, особливо у пацієнтів з ВІЛ/СНІДом або тяжкою кахексією.
У психіатрії досліджується використання канабіноїдів у лікуванні посттравматичного стресового розладу (ПТСР), генералізованої тривоги, обсесивно-компульсивного синдрому. Основний терапевтичний механізм полягає в здатності КБД впливати на мережі страху, нейропластичність та ослаблення патологічних емоційних спогадів. Клінічні спостереження показують зниження рівня тривоги, поліпшення сну, зменшення частоти флешбеків у пацієнтів із ПТСР при використанні КБД у дозах 300-600 мг/добу.
У нейродегенеративних захворюваннях, таких як хвороба Альцгеймера, Паркінсона, Гантінгтона, канабіноїди демонструють антиоксидантну, протизапальну та нейропротекторну дію. Ці ефекти пов’язують з активацією CB2-рецепторів мікроглії, зменшенням нейрозапалення, інгібуванням агрегації білків і стабілізацією мітохондріальної функції. Хоча поки що не існує затверджених протоколів, експериментальні дані підтримують подальші дослідження в цьому напрямку.
Окрему увагу привертає імуномодулювальний потенціал канабіноїдів. CB2-рецептори присутні на клітинах імунної системи: В-лімфоцитах, макрофагах, нейтрофілах, дендритних клітинах. Їх активація призводить до зменшення продукції прозапальних цитокінів (TNF-α, IL-1β, IL-6), гальмування проліферації Т-клітин, стимуляції регуляторного фенотипу. Це відкриває можливості для використання канабіноїдів при аутоімунних захворюваннях – системному червоному вовчаку, ревматоїдному артриті, розсіяному склерозі.
У сфері дерматології канабіноїди застосовують при атопічному дерматиті, псоріазі, акне. Їх дія зумовлена пригніченням продукції себуму, зменшенням проліферації кератиноцитів і модуляцією локальної імунної відповіді. Препарати на основі КБД у формі кремів або мазей демонструють ефективність у зменшенні запалення, свербежу, гіперкератозу.
Кардіометаболічний вплив канабіноїдів поки що досліджується обмежено. Є дані про покращення інсулінової чутливості, зниження концентрації С-реактивного білка й деяке зменшення індексу маси тіла при хронічному вживанні КБД. Механізми цього впливу включають модуляцію PPARγ, AMPK, а також вплив на жирову тканину через CB1-рецептори. Але надмірне вживання ТГК, навпаки, може асоціюватися з кардіореспіраторними ризиками.
Канабіс також використовується в паліативній медицині. Пацієнти з термінальними стадіями онкології, нейродегенеративних хвороб або тяжкої серцевої недостатності отримують користь від зменшення болю, тривоги, нудоти, порушень апетиту. Канабіноїди поліпшують якість життя, знижують потребу в опіоїдах, що особливо важливо у контексті ризику залежності.
Інтенсивно розвивається галузь персоналізованої канабіноїдної терапії. Враховуються генетичні варіанти ферментів (CYP2C9, CYP3A4), рецепторів CB1, CB2, а також індивідуальний ендотип дефіциту або гіперактивності ендоканабіноїдної системи. Цей підхід дозволяє мінімізувати побічні ефекти, уникнути небажаних взаємодій з іншими препаратами та забезпечити ефективну біоіндивідуальну підтримку.
Щоб зрозуміти терапевтичний потенціал канабісу, потрібно усвідомлювати через які рецептори канабіс взаємодіє з ендоканабіноїдною системою нашого організму. Це насамперед CB1, CB2, а також низка ванілоїдних, серотонінових, аденозинових, ядерних і транзиторних рецепторів. Завдяки такому спектру мішеней, фітоканабіноїди здатні модулювати як центральні, так і периферичні механізми, забезпечуючи широку терапевтичну амплітуду.
Побічні ефекти, ризики та перспективи
Попри значний терапевтичний потенціал, застосування канабісу пов’язане з низкою ризиків, що залежать від дози, хімічного складу, тривалості використання, способу введення і чутливості конкретного пацієнта. Вивчення побічних ефектів має критичне значення, оскільки неправильне дозування або самостійне застосування препаратів на основі канабісу може не лише знизити ефективність лікування, але й викликати небажані фізіологічні або психічні реакції. Медичний канабіс не є універсально безпечним засобом і потребує чітких стандартів фармаконагляду.
Одним із найчастіших побічних ефектів є когнітивні порушення, зокрема зниження концентрації, сповільнення реакцій, тимчасове ослаблення короткочасної пам’яті. Ці зміни найбільш виражені при вживанні препаратів, що містять високі дози дельта-9-тетрагідроканабінолу (ТГК), особливо у пацієнтів без толерантності до психоактивної дії. У підлітковому віці регулярне використання ТГК асоціюється з підвищеним ризиком зниження IQ, змінами в структурі префронтальної кори та порушенням нейророзвитку.
Психіатричні ускладнення можуть проявлятись у вигляді тривожності, панічних атак, параноїдальних думок, іноді – індукованих психозів. Особливо вразливими є особи з генетичною схильністю до шизофренії або біполярного афективного розладу. Дані нейровізуалізацій показують, що ТГК впливає на дофамінергічні та глутаматергічні шляхи, які беруть участь у регуляції емоцій і мислення, що пояснює потенційний ризик психотичних епізодів у чутливих індивідів.
З боку серцево-судинної системи спостерігаються тахікардія, коливання артеріального тиску, вазодилатація. У осіб із латентною ішемічною хворобою серця або аритміями можливе загострення кардіологічних симптомів. Існують повідомлення про випадки інфаркту міокарда, інсульту, серцевих аритмій, асоційованих з високими дозами ТГК, особливо у пацієнтів, які одночасно вживають тютюн або інші психоактивні речовини.
Респіраторні ефекти пов’язані переважно з курінням канабісу, а не з фармацевтичними формами. Хронічне вдихання диму може спричинити бронхіт, кашель, задишку, гіперреактивність бронхів. Дим канабісу містить поліциклічні ароматичні вуглеводні, подібні до тих, що наявні в тютюні, що підвищує онкологічні ризики при довготривалому використанні. Альтернативні способи введення – сублінгвальні спреї, капсули, настоянки, інгалятори – мінімізують ці ефекти, але вимагають точного дозування.
Порушення моторної координації, сповільнена реакція та сонливість підвищують ризик нещасних випадків. Пацієнти, які приймають канабіноїди, повинні утримуватись від керування транспортом або роботи з потенційно небезпечними механізмами протягом щонайменше кількох годин після прийому. Особливо це стосується осіб без попереднього досвіду вживання або тих, хто комбінує канабіс із алкоголем чи седативними препаратами.
Формування залежності можливе, хоча ризик нижчий порівняно з опіоїдами, нікотином чи алкоголем. Близько 9-10% осіб, які регулярно вживають канабіс, розвивають залежність, що проявляється психоемоційним дискомфортом при відміні, дратівливістю, безсонням, зниженим апетитом. Синдром відміни менш виражений, ніж при опіоїдній або бензодіазепіновій залежності, але може бути клінічно значущим у чутливих пацієнтів.
Ризик лікарських взаємодій також потребує уваги. Канабіноїди метаболізуються в основному через ізоферменти CYP3A4 і CYP2C9, які також залучені в метаболізм багатьох інших препаратів, зокрема антикоагулянтів, антидепресантів, імунодепресантів. Потенційна інгібіція або індукція цих ферментів може спричинити токсичність або зниження ефективності супутньої терапії.
З огляду на індивідуальні варіації в метаболізмі, чутливості рецепторів і реакціях на канабіноїди, важливо впроваджувати персоналізовані моделі призначення препаратів. Генетичне тестування, моніторинг фармакокінетики та фармакодинаміки, а також точна стратифікація пацієнтів за ризиками дозволяють підвищити безпеку терапії. Особливу увагу слід приділяти дітям, вагітним жінкам і особам літнього віку, де ризик несприятливих ефектів зростає через змінену фармакологічну відповідь.
Водночас актуальним є питання довготривалих наслідків регулярного використання канабіноїдів. Хоча деякі дані свідчать про зниження запалення, нейропротекцію та метаболічні переваги, інші вказують на потенційну десенсибілізацію рецепторів CB1, що може призвести до порушення роботи ендоканабіноїдної системи при тривалому надмірному навантаженні. Це, в свою чергу, може спровокувати функціональні збої у регуляції болю, настрою, сну та імунітету.
З погляду перспектив розвитку канабіноїдної терапії, очікується поява селективних агоністів і антагоністів рецепторів CB1/CB2, молекул з низьким психоактивним потенціалом, синтетичних аналогів КБД з підвищеною біодоступністю. Також триває розробка комбінованих схем із іншими лікарськими засобами – анальгетиками, протисудомними, анксіолітиками – для досягнення синергічного ефекту з мінімізацією дози канабіноїдів.
Новим напрямом є створення рецептур, спрямованих на вплив не лише на канабіноїдні рецептори, а й на інші мішені: рецептори TRP, GPR55, аденозинові, PPAR. Це дозволить розширити терапевтичну дію і зменшити психоактивні побічні ефекти. Розробляються нанотехнологічні платформи доставки, що забезпечують контрольоване вивільнення активних компонентів, точне дозування й зниження системної токсичності.
Перспективи клінічного використання канабісу також залежать від нормативного середовища. Легалізація медичного застосування в низці країн відкрила доступ до систематичних клінічних випробувань, розширення терапевтичних показань, стандартизації виробництва. Проте в багатьох регіонах канабіс досі розглядається виключно як наркотичний засіб, що стримує науковий прогрес і доступність для пацієнтів.
Ще одним перспективним вектором є інтеграція канабіноїдної терапії у комплементарну медицину: поєднання з нутритивною підтримкою, фізіотерапією, когнітивно-поведінковою терапією. Такий підхід особливо актуальний при хронічних поліетіологічних станах, де потрібне багатовекторне втручання з мінімальними побічними ефектами.
Висновок:
Ендоканабіноїдна система (ЕКС) – це складна, інтегративна сигнальна мережа, яка функціонально пов’язана з більшістю ключових фізіологічних процесів організму. Вона складається з ендогенних лігандів (анандамід, 2-АГ), специфічних рецепторів (переважно CB1 та CB2), транспортних білків і ферментів, що регулюють синтез і деградацію канабіноїдів. Взаємодія між цими компонентами забезпечує тонке налаштування міжклітинної комунікації, швидке реагування на стресори, підтримку гомеостазу та динамічну адаптацію до внутрішніх і зовнішніх змін. Її активність охоплює центральну й периферичну нервову систему, імунну відповідь, метаболізм, гормональну регуляцію, модуляцію болю, сну, терморегуляції та настрою.
ЕКС діє не як ізольована система, а як регуляторна надбудова, що впливає на діяльність інших систем організму, зокрема нервової, ендокринної, імунної, травної та серцево-судинної. Її специфічність полягає у зворотному (ретроградному) механізмі сигналізації, коли ендоканабіноїди синтезуються “на вимогу” постсинаптичною клітиною та пригнічують активність пресинаптичного нейрона. Це дозволяє регулювати інтенсивність нейрональної активності, пригнічуючи надмірну стимуляцію або збудження. CB1-рецептори є надзвичайно щільно представлені в головному мозку, зокрема в гіпокампі, базальних гангліях, мозочку, що обумовлює їхню участь у когнітивній, моторній та емоційній регуляції. CB2-рецептори переважно експресуються в імунних клітинах, модулюючи прозапальні каскади, апоптоз і міграцію клітин.
Одним з ключових викликів для фізіології є стан клінічного дефіциту ЕКС – дисфункціональний стан, при якому знижений рівень ендоканабіноїдів або порушена рецепторна відповідь призводить до патологічного розбалансування процесів регуляції. Цей дефіцит може бути первинним (генетично обумовленим) або вторинним (набутим унаслідок хронічного стресу, нейрозапалення, травм, інфекцій, старіння). Низька активність ЕКС пов’язана з розвитком цілої низки станів – від мігрені, фіброміалгії та синдрому подразненого кишківника до депресії, тривожних розладів і нейродегенеративних хвороб. Ці зв’язки не є лише кореляційними – сучасна експериментальна база підтверджує причинно-наслідковий вплив порушення тонусу ЕКС на виникнення стійкої патології.
У цьому контексті зростає роль терапевтичної модуляції ЕКС. Сучасні підходи до корекції дефіциту передбачають як фармакологічні втручання – застосування природних і синтетичних канабіноїдів, інгібіторів ферментів FAAH/MAGL, селективних агоністів CB1/CB2, так і нефармакологічні – дієтичні стратегії, фізична активність, практика стрес-редукції, нормалізація сну. Підхід до модуляції ЕКС повинен бути персоналізованим і базуватись на валідації рівнів ендоканабіноїдів та рецепторної активності. Надмірна або неконтрольована стимуляція може, навпаки, погіршити адаптивні можливості системи через десенсибілізацію рецепторів.
Особливе місце займає взаємодія ЕКС з канабісом. Фітоканабіноїди, насамперед ТГК і КБД, мають потенціал модуляції активності CB-рецепторів і пов’язаних сигнальних каскадів. ТГК діє як частковий агоніст CB1, що зумовлює його психоактивні ефекти, тоді як КБД має слабку афінність до класичних канабіноїдних рецепторів, але впливає на алостеричну модуляцію, зворотний захват анандаміду, і інші сигнальні мішені – PPARγ, TRPV1, GPR55. Фармакологічний профіль канабісу залежить не лише від співвідношення ТГК/КБД, а й від вмісту терпенів, флавоноїдів, канабігеролу та інших неканонічних канабіноїдів.
Медичне застосування канабісу показує перспективні результати в лікуванні болю, епілепсії, склерозу, хвороби Паркінсона, аутизму, ПТСР та онкопаліативних станів. Проте його впровадження супроводжується ризиками: когнітивними порушеннями, залежністю, психотичними епізодами, кардіоваскулярними ускладненнями, негативним впливом на нейророзвиток у підлітків. Безпека застосування вимагає регламентованих доз, чіткого контролю якості препаратів, лікарського моніторингу та правового регулювання. Наукові дослідження зосереджені на пошуку селективних канабіноїдів з мінімальними побічними ефектами, розвитку нетрадиційних форм доставки (наноформуляції, інгалятори, трансдермальні системи), а також використанні ЕКС як терапевтичної мішені для препаратів нового покоління.
У перспективі ЕКС перестає розглядатися лише як фармакологічна ціль. Вона стає системою, інтегрованою в клінічну діагностику, скринінг ризиків, стратегії профілактики, а також платформою для створення індивідуалізованої медицини. Її унікальна здатність координувати функції різних систем організму, реагувати на змінні умови та підтримувати баланс між процесами активації і гальмування робить її одним з ключових регуляторів гомеостазу та мішенню майбутніх мультисистемних терапевтичних стратегій.
Джерела:
- Endocannabinoid System: Overview and Clinical Implications
Джерело: National Center for Biotechnology Information (NCBI), PubMed Central
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3998222/ - The Endocannabinoid System and its Therapeutic Exploitation
Джерело: Nature Reviews Drug Discovery
https://www.nature.com/articles/nrd.2015.16 - Endocannabinoid System in Health and Disease: An Overview
Джерело: Frontiers in Neuroscience
https://www.frontiersin.org/articles/10.3389/fnins.2018.00025/full - Cannabinoid Receptors and Their Endogenous Ligands
Джерело: British Journal of Pharmacology, Wiley Online Library
https://bpspubs.onlinelibrary.wiley.com/doi/full/10.1111/bph.13118 - Clinical Endocannabinoid Deficiency: Can This Concept Explain Therapeutic Benefits of Cannabis in Migraine, Fibromyalgia, Irritable Bowel Syndrome?
Джерело: Neuroendocrinology Letters
https://www.nel.edu/userfiles/articlesnew/NEL320509A04.pdf - Pharmacology of Cannabinoids
Джерело: Pharmacological Reviews, American Society for Pharmacology and Experimental Therapeutics (ASPET)
https://pharmrev.aspetjournals.org/content/68/4/1103 - Therapeutic Potential of Cannabinoids in Neurological Disorders
Джерело: Journal of Neurology, Neurosurgery & Psychiatry, BMJ
https://jnnp.bmj.com/content/89/7/741 - Endocannabinoid System and Immune Regulation: A Role for Cannabinoids in Modulating Immune Response
Джерело: Journal of Leukocyte Biology
https://jlb.onlinelibrary.wiley.com/doi/full/10.1189/jlb.3RI0713-379R - Medical Cannabis and Cannabinoids: Evidence and Practice
Джерело: Royal Australian College of General Practitioners (RACGP)
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/medical-cannabis - Safety and Side Effects of Cannabinoids
Джерело: Drug Safety Journal, SpringerLink
https://link.springer.com/article/10.2165/00002018-200746090-00004