Канабіноїдна система, хоч і є відносно новим об’єктом цілеспрямованого фармакологічного аналізу, вже продемонструвала виняткову гнучкість у контексті структури-активності (SAR) своїх лігандів. Серед природних та синтетичних канабіноїдів дельта-9-тетрагідроканабінол (Δ9-THC) залишається найвідомішим завдяки своїм психоактивним властивостям і високій афінності до CB1-рецепторів. Однак обмеження щодо його клінічного застосування, зумовлені психотропністю, непередбачуваною фармакокінетикою та етичними/правовими бар’єрами, стимулюють наукову спільноту до пошуку модифікованих похідних з альтернативним або селективним біологічним профілем. Саме в цьому контексті тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) привертає увагу як потенційно важливий компонент у хімічній еволюції канабіноїдів.
TriOH-THC – це малодосліджений оксигенований метаболіт Δ9-THC, який формується внаслідок гідроксилювання канабіноїдного ядра. У науковій літературі його наявність вперше описано у межах метаболічного профілю, що виникає внаслідок інтенсивної трансформації Δ9-THC у печінці. При цьому більшість досліджень фокусувалася лише на 11-гідрокси-Δ9-THC (11-OH-THC) – основному активному метаболіті з посиленою психоактивністю. Водночас triOH-THC, що містить три гідроксильні групи в різних позиціях терпенового скелета, залишається на периферії фармакологічного інтересу, попри свою потенційну біоактивність та хімічну унікальність.
Механістично гідроксилювання Δ9-THC відбувається переважно за участю ферментів родини цитохрому P450 (особливо CYP2C9 і CYP3A4), які здійснюють регіо- і стереоселективне окислення. У класичному метаболічному сценарії першим етапом є перетворення Δ9-THC на 11-OH-THC, далі – на 11-nor-9-carboxy-THC (THC-COOH), який є фармакологічно неактивним. Однак при певних умовах або у присутності індукторів оксидаз можливе утворення додаткових гідроксильованих похідних – включно з triOH-THC. Ймовірні шляхи включають гідроксилювання в положеннях 8α, 8β, 10α або 1′-метильній групі – внаслідок чого формується трифункціональна сполука з підвищеною полярністю та зміненим зв’язуванням із рецепторами.
З погляду хімічної інженерії, triOH-THC відкриває новий вектор у структурній модифікації канабіноїдів. Тригідроксильовані аналоги зазвичай мають знижений психоактивний потенціал, але демонструють модифіковану рецепторну селективність, посилене зв’язування з CB2 або здатність до взаємодії з неканонічними мішенями, зокрема PPARγ, TRPV1 чи GPR55. Це потенційно робить triOH-THC перспективним кандидатом у терапії запалення, нейродегенерації або болю, не викликаючи психотропних ефектів, властивих Δ9-THC.
Окремо слід відзначити, що наявність трьох гідроксильних груп значно впливає на фізико-хімічні властивості сполуки. TriOH-THC має знижену ліпофільність порівняно з батьківською молекулою, що може змінити її здатність проникати через гематоенцефалічний бар’єр, але водночас підвищити її біодоступність при парентеральному введенні або вплив на периферичні тканини. Окрім того, такі гідроксигрупи створюють потенціал для додаткового водневого зв’язування, що важливо при взаємодії з білками-рецепторами, і відкриває перспективи у створенні селективних лігандів або прототипів для ліків.
Попри це, доступність triOH-THC у чистому вигляді залишається значною експериментальною проблемою. Синтетичне отримання вимагає високоточної регіоселективної гідроксиляції в присутності терпенової основи, яка є хімічно нестабільною до окиснення. Дослідницькі групи пропонують використання біокаталізаторів або ферментативного синтезу in vitro, що є більш контрольованими щодо продуктивності, але потребують складної експресії відповідних ферментів і оптимізації умов середовища. Альтернативним шляхом є модифікація природного Δ9-THC з рослин канабісу у присутності активованих мікробних культур або ферментів, із подальшою хроматографічною очисткою продукту.
Наразі тригідроксильовані форми Δ9-THC не є комерційно доступними й не входять до фармакопейних довідників. Їх присутність в організмі вважається транзиторною та обмеженою, що ще більше ускладнює їх дослідження. Відсутність аналітичних стандартів для triOH-THC призводить до недооцінки його у фармакокінетичних дослідженнях, особливо при вивченні плазмових метаболітів у користувачів канабісу. Це ставить питання про потенційну роль triOH-THC як прихованого або “невидимого” учасника канабіноїдної фармакодинаміки.
У деяких експериментальних роботах із токсикології та метаболоміки були виявлені фрагменти, ідентичні гідроксильованим похідним Δ9-THC, що відповідають молекулярній масі triOH-THC. Це свідчить про його участь у біотрансформації, однак подальші дані залишаються неповними. Деякі непрямі докази вказують на участь triOH-THC у формуванні вторинних ефектів після хронічного вживання канабісу, можливо, як антагоніст або модулятор ефектів інших метаболітів.
У фокусі сучасної хімії канабіноїдів тригідроксильовані похідні відкривають принципово новий клас молекулярних структур із потенційно вибірковими фармакологічними характеристиками. На відміну від повністю синтетичних канабіноїдів, які часто демонструють надмірну активність або токсичність, triOH-THC є продуктом природного або напівприродного біосинтезу й може бути використаний як шаблон для подальшої оптимізації лігандів. Можна очікувати, що в майбутньому triOH-THC або його аналоги стануть об’єктами досліджень в контексті створення непсихоактивних протизапальних, анальгетичних або нейропротекторних засобів.
Хімічна ідентичність triOH-THC
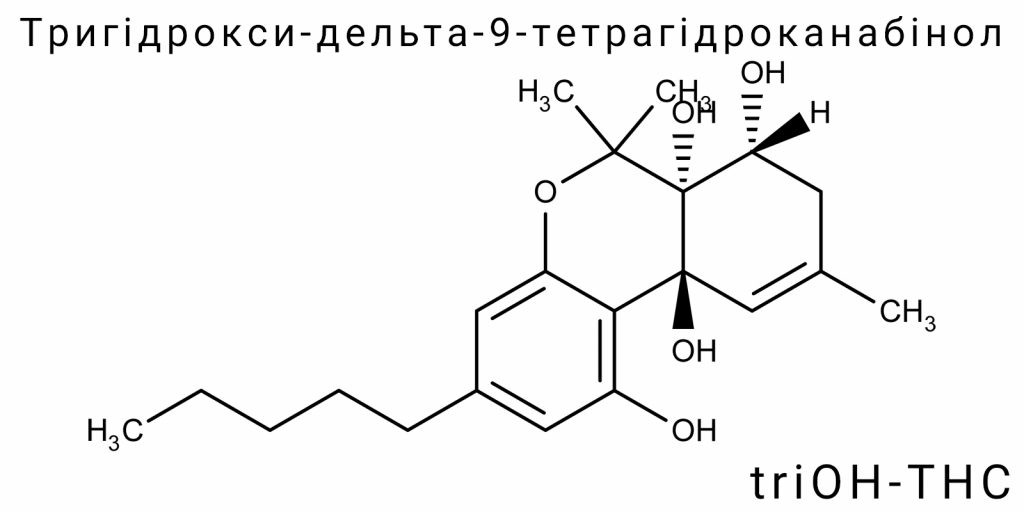
Тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) є похідною Δ9-тетрагідроканабінолу з трьома гідроксильними групами, введеними до молекули у вигляді вторинних або третинних спиртів. Ця модифікація істотно змінює як електронну структуру молекули, так і її реакційну здатність, утворюючи новий клас полярних канабіноїдів, які відрізняються від як класичних фітоканабіноїдів (Δ9-THC, Δ8-THC), так і оксидованих метаболітів (11-OH-THC, THC-COOH). На відміну від інших метаболітів Δ9-THC, triOH-THC не є монофункціональним, а становить приклад поліфункціоналізованої молекули з потенційно зміненою біоактивністю, специфічною топологією електронної густини і зміненим патерном взаємодії з білковими мішенями.
Основна канабіноїдна структура Δ9-THC складається з трьох ключових фрагментів: трисубституйованого бензольного кільця (резорцинова частина), терпенового циклу (цис-гексагідро-6H-дибензо[b,d]піперану) і бічного алкільного ланцюга у положенні 3. Гідроксигрупа в положенні 1 на бензольному кільці є спільною рисою всіх класичних канабіноїдів, яка забезпечує можливість водневого зв’язування з рецепторами CB1/CB2. У випадку triOH-THC додаються ще дві гідроксильні групи, які можуть бути локалізовані у кількох позиціях: найчастіше – в положеннях 8 (на терпеновому кільці), 11 (на метиленовій групі біля подвійного зв’язку) або на боковому ланцюзі. Залежно від позиції введення гідроксигруп, можливі декілька структурних ізомерів triOH-THC, кожен з яких має відмінну просторову конфігурацію, ступінь конформаційної гнучкості та електронну щільність у ключових вузлах взаємодії з рецепторами.
Найбільш імовірними кандидатами на позиції гідроксилювання є атоми в положеннях:
- 11 – класичний шлях гідроксилювання Δ9-THC у печінці за участю CYP2C9/CYP3A4.
- 8β або 8α – часте місце метаболічної трансформації канабіноїдів у людини та інших видів.
- 10α – менш стабільне, але зафіксоване в ряді in vitro експериментів положення гідроксилювання.
- 1′-метильна група на бічному ланцюзі – особливо при участі мікросомальних ферментів.
Таким чином, triOH-THC не є єдиною молекулою, а структурно неоднорідною групою похідних з однаковою формулою, але різними властивостями. Наприклад, 1-hydroxy-8α,11-dihydroxy-THC і 1-hydroxy-8β,11-dihydroxy-THC є стереоізомерами, які можуть відрізнятися в афінності до рецепторів у десятки разів. Їх ізоляція й охарактеризування вимагає методів хіральної хроматографії або ядерного магнітного резонансу з використанням 2D-COSY та NOESY, що досі майже не застосовувалися до triOH-THC.
Зміна ступеня гідроксилювання різко впливає на кислотно-основні властивості сполуки. Додаткові гідроксигрупи знижують pKa бензольної гідроксигрупи завдяки ефекту електронного відтягування, що може змінити іонізацію молекули у фізіологічних умовах. Це має критичне значення для передбачення пасивної дифузії через клітинні мембрани. У той час як Δ9-THC демонструє високий коефіцієнт розподілу (logP ≈ 6.4), triOH-THC має значно нижчий logP (попередні моделювання вказують на значення в діапазоні 2.8-3.5), що свідчить про знижену ліпофільність і потенційно змінену фармакокінетику.
Хімічна стабільність triOH-THC також істотно нижча. Тригідроксильовані похідні канабіноїдів мають вищу схильність до автокаталізованого окиснення та деградації, особливо при контакті з киснем, світлом або металевими іонами. Це обмежує їх тривале зберігання та ускладнює роботу з аналітичними зразками. При звичайному зберіганні в розчинниках, таких як метанол або етанол, triOH-THC може піддаватися етерифікації або дегідратації, що ще більше ускладнює точну ідентифікацію при мас-спектрометрії.
Ще одним ключовим аспектом є полярність triOH-THC у контексті водорозчинності. Δ9-THC є практично нерозчинним у воді (≈2.8 µg/mL), що значно ускладнює його фармацевтичне формулювання. У випадку triOH-THC гідрофільність зростає, хоча залишки вуглеводневої частини залишаються значними. Це створює підґрунтя для можливого включення у формули типу мікроемульсій, ліпосом або полімерних наночастинок – технологій, що дозволяють оптимізувати фармакологічну доставку.
Щодо аналітичної ідентифікації triOH-THC, жоден з існуючих стандартних методів (високоефективна рідинна хроматографія з УФ-детекцією, LC-MS/MS, газова хроматографія) не є достатньо валідованим для цього класу сполук. Більше того, у токсикологічних аналізах крові чи сечі зазвичай відсутні аналітичні стандарти для triOH-THC, що призводить до його нерозпізнавання. Навіть при використанні мас-спектрометрії високої роздільності (HR-MS) молекули triOH-THC можуть залишатися поза межами виявлення через нестабільність при іонізації або перекриття сигналів з іншими метаболітами.
Молекулярна структура
Молекулярна структура тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) є прикладом функціонально ускладненої похідної класичного Δ⁹-тетрагідроканабінолу, модифікованої за рахунок додаткових трьох гідроксильних груп, розміщення яких суттєво змінює геометричні, електронні та міжатомні характеристики молекули. Важливо, що на відміну від простих метаболітів або напівсинтетичних похідних, triOH-THC не має фіксованої конфігурації – він представлений у вигляді ансамблю ізомерів, кожен з яких може мати унікальну молекулярну архітектоніку. Саме це ускладнює його кристалографічне картування та моделювання, вимагаючи комплексного квантово-механічного підходу.
Основна каркасна система triOH-THC ґрунтується на трициклічній структурі – тетрагідро-6H-дибензо[b,d]піперану – до якої приєднані три гідроксильні функції, зазвичай у положеннях C1 (на ароматичному кільці), C8 (на насиченому циклі) та C11 (в алільному положенні). Впровадження гідроксильних груп у насичені позиції призводить до переходу атомів вуглецю від sp³ до частково sp²/planar гібридизаційних станів, що локально порушує симетрію тетрагідроканабіноїдного каркасу.
З погляду геометрії, вплив гідроксилювання у положенні C11, де зазвичай формується первинний алільний спирт, має ключове значення: виникає новий центр асиметрії, який підлягає таутомерній нестабільності та може переходити у карбонільну форму через окиснення. Гідроксил у C8 (особливо у β-конфігурації) формує стерично напружену ділянку, де відбувається деформація циклу С6-С7-С8-С9, що веде до зменшення внутрішнього діедрального кута і потенційного утворення внутрішньомолекулярних водневих зв’язків між OH-групами та киснем бензольного кільця.
Бічний алкільний ланцюг, прикріплений до положення C3, відіграє критичну роль у формуванні ліпофільного ядра молекули. У класичному Δ⁹-THC це бутиловий або пентиловий ланцюг, але при перетворенні на triOH-THC можливе його часткове окиснення або гідроксилювання в положенні ω або ω-1, що трансформує гнучку ліпофільну частину в частково полярну, обмежуючи обертання навколо зв’язків С-С та знижуючи здатність молекули до адаптивного укладання при взаємодії з білками. Це локальне зниження ентропії конформацій призводить до більш чіткої фіксації молекули в рецепторних порожнинах, з потенційно новими точками водневого з’єднання або диполь-дипольної взаємодії.
Оцінка молекулярної топології за допомогою DFT-методів (рівень теорії B3LYP/6-31G**) показує, що електронна густина значно зростає на гідроксильованих ділянках, особливо у випадку, якщо всі три OH-групи орієнтовані у просторі в одній півсфері молекули. Це створює локалізований гідрофільний полюс, що кардинально змінює дипольний момент (μ) молекули – із 1.7-2.0 D для Δ⁹-THC до понад 4.5-5.1 D для triOH-THC, залежно від конформації. Така асиметрія електростатичного поля може спричинити зовсім інший профіль афінності до рецепторів – з перевагою взаємодії не з гідрофобними ділянками CB1/CB2, а з гідрофільними глікановими структурами транспортних або плазматичних білків.
У розрізі об’ємно-просторової структури варто зазначити, що введення трьох гідроксильних груп призводить до зростання об’єму Ван дер Ваальса молекули щонайменше на 8-11%. З одного боку, це підвищує щільність міжмолекулярних контактів при ліганд-рецепторній взаємодії, а з іншого – знижує мембранну проникність через збільшення молекулярного об’єму (≈590-610 ų, проти ≈510 ų у Δ⁹-THC). Структурні розрахунки за методом аналізу поверхні електростатичного потенціалу (MEP) демонструють сильне електронне перенавантаження у ділянці ароматичного кільця з гідроксилом у положенні C1, особливо при формуванні внутрішнього циклічного водневого зв’язку з OH у C8.
Важливо, що в triOH-THC спостерігається значне обмеження конформаційної свободи між терпеновим і бензольним кільцями. Якщо в Δ⁹-THC можливе майже вільне обертання між цими фрагментами, то додаткові OH-групи створюють локальні мережі водневих зв’язків, які стабілізують одну або дві основні конформації. Цей ефект так званої “фіксації кільця” зменшує ентропію вільного стану ліганду та впливає на зв’язування з білковими сайтами через зменшення енергетичних витрат на фіксацію при комплексоутворенні.
Варто відзначити і те, що внаслідок триразового гідроксилювання, на молекулі triOH-THC з’являється потенційна можливість формування хелатних структур з дво- та тривалентними катіонами, такими як Mg²⁺, Zn²⁺ або Fe³⁺. Ця властивість відсутня у звичайному Δ⁹-THC і створює умови для зовсім іншого типу молекулярної взаємодії – зокрема, селективного накопичення в тканинах із високим рівнем іонів металів або впливу на металоферменти, наприклад, фосфатази або оксидоредуктази.
Також варто враховувати, що гідроксигрупи triOH-THC можуть підлягати фосфорилюванню в умовах клітинного середовища, що перетворює молекулу на трифосфатний етер – потенційно здатний до участі в сигнальних шляхах або взаємодії з мембранними кіназами. Такий механізм фармакологічної модуляції для канабіноїдів ще не описаний, але наявність трьох OH-груп створює реальні умови для аналогії з фенольними катехоламінами, як-от норадреналін.
З точки зору ковалентної хімії, розташування трьох гідроксигруп в triOH-THC відкриває нові реакційні траєкторії: селективне ацилювання, утворення естерів, сульфатів або карбонатів. Зокрема, наявність двох сусідніх OH-груп (у положеннях 1 і 8) може призводити до утворення циклічних шести- або семичленних естерів, які є реакційно активними інтермедіатами – з чіткими спектральними проявами у ¹H NMR (δ 4.2-5.1 ppm) та характерними сигналами в IR-діапазоні (νC-O 1250-1280 cm⁻¹). Такі модифіковані структури можуть мати абсолютно інші фармакодинамічні властивості, зокрема, пролонгований період напіввиведення або змінену метаболічну долю.
Стереохімія та ізомери
Стереохімія тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) є критичним аспектом для розуміння його біохімічної поведінки, адже три гідроксильні заміщення створюють множинність хіральних центрів, зумовлюючи існування кількох десятків теоретично можливих стереоізомерів. Ключові варіації виникають не лише за рахунок наявності класичних sp³-хіральних атомів вуглецю, але й через аксіальну хіральність, пов’язану з обмеженням обертання навколо міжкільцевих σ-зв’язків, зумовленим формуванням водневих зв’язків між OH-групами.
Основна платформа triOH-THC складається з трициклічного каркасу з кількома можливими хіральними центрами. У більшості природних і синтетичних варіантів Δ⁹-THC центри хіральності локалізуються у положеннях C6а, C10a та C8. Вводячи гідроксильні групи в позиції C1, C8 і C11, ми додаємо ще щонайменше два хіральні центри – у випадку гідроксилювання насичених положень – що розширює кількість енантіомерів та діастереомерів до понад 16 теоретичних форм навіть без урахування таутомерії.
Гідроксил у положенні C8 може бути орієнтований як у β-, так і в α-конфігурації, що в просторі змінює кут між кільцями B та C. У β-формі утворюється локальна конформація типу “chair-boat”, в якій C8-OH утримується у псевдоаксіальному положенні, сприяючи формуванню стабільного внутрішньомолекулярного водневого зв’язку з киснем С1-OH. У випадку α-орієнтації гідроксил зміщується до екваторіального положення, що послаблює ці міжгрупові взаємодії, натомість сприяє утворенню контактів із молекулами води або іонами в оточуючому середовищі.
Хіральність у положенні C11 виникає лише при наявності спиртової групи. У разі, якщо тут утворюється вторинний або первинний спирт, ми отримуємо асиметричний центр, який може існувати у двох енантіоморфних формах. У живому середовищі можливий також динамічний міжперехід між ними, якщо не відбувається фіксація у ферментативному або білковому комплексі. У випадку окиснення до альдегіду чи кетону хіральність втрачається, проте з’являється плоский sp²-гібридизований центр, який формує π-систему з електронною делокалізацією у бічному ланцюгу – це важливо для взаємодії з ароматичними залишками білків-мішеней.
Особливої уваги заслуговує положення C6а, де стереохімія відіграє фундаментальну роль у визначенні просторового профілю всього молекулярного каркасу. В класичному Δ⁹-THC переважає 6аR,10aR-конфігурація. При гідроксилюванні, конформаційна стабільність змінюється внаслідок розбалансування енергетики обертань та торсійної напруги. У triOH-THC деякі діастереомери із зміненим C6a конфігураційним знаком можуть набувати більшої термодинамічної стабільності через утворення водневих мереж, що блокують обертання між циклами.
Слід розрізняти три типи ізомерії, що мають значення у triOH-THC: енантіомерія, діастереомерія і конформаційна ізомерія. Енантіомери – дзеркальні відображення один одного – не перетворюються одне в одного без розриву ковалентних зв’язків. У випадку triOH-THC їх фармакологічна дія може бути радикально різною: один енантіомер може мати афінність до CB2-рецептора, тоді як інший – до транспортних білків або зовсім не проявляти рецепторної активності. Діастереомери, натомість, мають різні фізичні властивості – температуру плавлення, розчинність, кут обертання, і можуть відрізнятись за конформаційним профілем взаємодії з мембранними білками.
Особливий клас стереоізомерії – аксіальна хіральність – формується у молекулах triOH-THC через часткову заборону обертання навколо σ-зв’язків, зокрема, між бензольним кільцем та циклоалкільним ядром. Якщо у Δ⁹-THC ці обертання вільні, то присутність гідроксильних груп у положеннях, що можуть формувати інтерциклічні водневі зв’язки, стабілізує конкретні торсійні кути. Таке “заморожування” ротацій створює хіральну вісь, яка не пов’язана з класичними асиметричними центрами, але все ж веде до існування стійких атропоізомерів. Ці форми є взаємно неперетворюваними при фізіологічних температурах і можуть мати окремий спектр біологічної активності.
Також варто згадати таутомерні форми, які хоча і не є стереоізомерами у вузькому сенсі, але спричиняють динамічну мінливість електронної щільності та розподілу диполів у молекулі. Зокрема, C11-OH може перебувати в рівновазі з C11=O, утворюючи хіральний центр тільки в одній формі. Це створює хемодинамічно лабільну систему, де реакційна здатність і спектр міжмолекулярних взаємодій залежить від поточного хімічного мікрооточення. У водних середовищах переважає гідроксильна форма, тоді як у ліпідних мембранах спостерігається зсув у бік енольної або кетонної структури.
Ще один аспект – епімерія, яка стосується ізомерів, що відрізняються конфігурацією лише в одному хіральному центрі. Для triOH-THC, наприклад, епімери в положенні C8 можуть мати протилежні фізико-хімічні властивості – наприклад, різну швидкість метаболізму через відмінності у впізнаванні ферментами (CYP450, UGTs). З позиції медичної хімії це відкриває перспективу синтезу контрольованих епімерних форм із подовженим або ослабленим ефектом.
Усі ці типи ізомерії мають спільну властивість – вони істотно впливають на фармакокінетику, фармакодинаміку та метаболізм triOH-THC. Наприклад, різні діастереомери можуть мати різну проникність через гематоенцефалічний бар’єр, а також різний профіль виведення – з перевагою екскреції через печінкову або ниркову систему. Відомо також, що деякі стереоізомери THC метаболізуються у 11-OH-форму з високою біоактивністю, і в triOH-THC цей шлях значно ускладнюється або навіть блокується через вже наявну гідроксигрупу в цьому положенні.
Походження і біосинтез
Тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) не є природним канабіноїдом у класичному сенсі цього терміна, тобто його не виявлено у вихідній біохімії Cannabis sativa в значущих кількостях. Проте він належить до класу оксидативно модифікованих метаболітів Δ⁹-тетрагідроканабінолу (Δ⁹-THC), які утворюються або в ході біотрансформації в організмі людини (як третинні метаболіти), або штучно – шляхом хімічного або ферментативного гідроксилювання у стратегічно визначених положеннях молекули. Саме тому його походження двоїсте і заслуговує на окремий аналіз у контексті сучасної хімії канабіноїдів.
З біогенетичної точки зору, triOH-THC є похідним вторинного метаболізму Δ⁹-THC, в якому відбувається послідовне гідроксилювання основного канабіноїда. В природі гідроксильні модифікації зазвичай є наслідком ферментативної активності оксидоредуктаз або монооксигеназ (зокрема ферментів родини CYP450), які виконують метаболічну детоксикацію ліпофільних ксенобіотиків. У контексті THC ця система відповідає за утворення 11-гідрокси-THC (11-OH-THC) – найбільш біоактивного метаболіту – та подальших поляризованих похідних.
TriOH-THC формується як результат подальшого метаболічного окиснення THC або 11-OH-THC з додаванням додаткових гідроксильних груп. Ймовірні положення для такої гідроксиляції – це C1, C8 та C11, з огляду на їхню доступність для ферментативного атаки та відносну електрофільність. Встановлено, що при високих дозах THC або при порушенні нормального метаболічного профілю (наприклад, у випадку генетичних варіантів CYP2C9) можуть утворюватися похідні з кількома гідроксигрупами, які значно відрізняються від батьківської молекули як за фармакокінетичними властивостями, так і за токсикологічним профілем.
У живому організмі цей процес має фазовий характер. У фазі І метаболізму THC зазнає окислення, гідроксилювання та деалкілування, з утворенням проміжних метаболітів. У фазі ІІ ці метаболіти кон’югуються з глюкуроновою кислотою або сульфатами, підвищуючи їхню гідрофільність і полегшуючи виведення. Утворення triOH-THC належить до глибокої стадії фази І, де молекула вже має кілька функціональних груп, що робить її нестабільною і менш активною в рецепторному плані, але потенційно важливою як сигнальний або імуномодулюючий агент.
Однак відомості про природну появу triOH-THC є обмеженими. Його рідкісна присутність у біологічних рідинах (наприклад, у плазмі або сечі) може бути виявлена лише за допомогою високо специфічної аналітики – зокрема методом рідинної хроматографії з тандемною мас-спектрометрією (LC-MS/MS) з використанням мульти-реконструйованих іонних переходів, оскільки стандартні скринінгові методи часто не розпізнають цю структуру через низький рівень її стабільності та концентрації.
Незважаючи на це, triOH-THC привертає увагу як хімічний артефакт, який може утворюватися у зразках, що зазнали часткового окиснення під час зберігання або обробки. Наприклад, тривале зберігання THC у присутності світла, кисню або підвищеної температури може призвести до поступової трансформації в гідроксильовані продукти. В таких умовах можлива автокаталітична гідроксилювання, при якому реакція радикального типу сприяє утворенню triOH-THC або споріднених похідних.
З неорганічної точки зору, синтез triOH-THC можливий із застосуванням контрольованого гідроксилювання вихідної молекули Δ⁹-THC або його простих аналогів. Найчастіше використовують електрофільне гідроксилювання за участі реагентів типу OsO₄, KMnO₄ або RuO₄ у присутності буферних систем, які зберігають інтегральність ароматичної системи. Для спрямованого додавання груп – наприклад, у позиції C8 – використовують металокомплексні каталізатори або ензим-міметики (синтетичні аналоги ферментів), що забезпечують високу регіоселективність реакції.
У біотехнологічному варіанті синтез triOH-THC проводиться з використанням цільових ферментів – зокрема мутантних варіантів P450 BM3 або CYP3A4, що мають модифіковану активну ділянку. Такі системи здатні забезпечити селективне гідроксилювання у важкодоступних положеннях за рахунок зміни локальної електростатичної карти молекули. Результатом є контрольоване отримання гідроксипохідних THC з мінімальним утворенням побічних продуктів.
Також розглядається можливість біосинтетичного отримання triOH-THC у модельних організмах – наприклад, у генетично модифікованих штамах Saccharomyces cerevisiae або Escherichia coli, що експресують повний набір ензимів, необхідних для синтезу канабіноїдів. До таких ферментів належать оліветолсинтаза, геранілтрансфераза, CBGA-синтаза, а також специфічні P450-оксидази. Додавши додаткові ензими для послідовного гідроксилювання, можна програмувати продукцію triOH-THC in vitro без потреби у натуральному канабісі.
Особливий інтерес також викликає можливість утворення triOH-THC внаслідок взаємодії з реактивними метаболітами інших речовин. Наприклад, відомо, що деякі лікарські засоби (наприклад, протиепілептичні препарати або імуномодулятори) впливають на активність P450-ферментів, змінюючи карту метаболізму THC. У певних умовах (наприклад, при прийомі CBD разом із THC) може виникати індукція додаткових ферментативних шляхів, які зумовлюють утворення надгідроксильованих форм, включаючи triOH-THC.
Метаболічний шлях в організмі
Метаболічна доля тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) в організмі пов’язана з глибокими стадіями окиснювального катаболізму Δ⁹-тетрагідроканабінолу, в яких беруть участь високо специфічні ферментативні системи, орієнтовані на генерацію полярних, функціоналізованих метаболітів з підвищеною водорозчинністю. Ці процеси не є первинними реакціями біотрансформації, а виникають у контексті розширеної ферментативної активності системи цитохрому P450, переважно в печінковій тканині, але також у периферичних мікросомальних фракціях.
Після перорального або інгаляційного надходження Δ⁹-THC швидко абсорбується через слизову шлунково-кишкового тракту або легеневий епітелій, потрапляючи до печінки через портальну вену (при ентеральному введенні) або безпосередньо до системного кровообігу (при інгаляціях). В печінці Δ⁹-THC піддається першій хвилі окиснювального метаболізму – переважно за участі ферментів CYP2C9, CYP2C19 і CYP3A4. Цей етап призводить до утворення активного метаболіту 11-гідрокси-THC, який є високопотентним агоністом канабіноїдних рецепторів CB₁.
Подальша метаболічна трансформація 11-OH-THC відбувається в другому ступені фази I. Тут ключову роль відіграє окиснення до 11-карбоксі-THC (THC-COOH), що значно знижує фармакологічну активність молекули, але відкриває можливість для додаткового окиснення у сусідніх або периферичних положеннях – особливо при умовах індукції ферментів, конкуренції субстратів або наявності атипових метаболічних умов. TriOH-THC утворюється в результаті додаткового гідроксилювання на різних вуглецевих центрах молекули, зазвичай у положеннях C1, C8 або C9, з утворенням трьох оксигруп, не пов’язаних між собою кон’югованою системою.
Механізм такого гідроксилювання є ферментативно регульованим і не є наслідком спонтанних автокаталітичних реакцій. Залучені ензими відносяться до класу P450-монооксигеназ, які каталізують реакції введення атома кисню в C-H зв’язки молекул. Ці ферменти використовують молекулярний кисень і NADPH як редуктор для утворення активного оксигенованого комплексу, який здійснює атакуюче гідроксилювання. Найбільш імовірно, що одночасне утворення трьох гідроксильних груп відбувається не в одній стадії, а через послідовне ферментативне додавання, з чергуванням утворення нестійких проміжних метаболітів.
Наявність трьох гідроксильних груп значно змінює фармакокінетичні параметри молекули. Підвищена гідрофільність знижує її афінність до ліпідного шару клітинних мембран, а також ускладнює проходження через гематоенцефалічний бар’єр. Це обмежує активність triOH-THC на рівні центральної нервової системи, що підтверджується слабким або невираженим психоактивним профілем цього метаболіту. Водночас, тригідроксильована структура забезпечує високу спорідненість до транспортних білків плазми та до ферментів кон’югації фази II, насамперед уридиндифосфат-глюкуронозилтрансфераз (UGT1A9, UGT2B7) та сульфотрансфераз (SULT1A1), які готують метаболіт до виведення із сечею або жовчю.
Елімінація triOH-THC в більшості випадків здійснюється в кон’югованій формі, тобто у вигляді глюкуронідів або сульфатів. Кон’югація проходить швидко, проте полярність молекули іноді ускладнює пасивну дифузію через мембрани гепатоцитів, що вимагає залучення транспортних білків типу MRP2 (multidrug resistance-associated protein 2) або BCRP (breast cancer resistance protein) для ефективного транспорту в жовчні канальці. Подальший шлях включає секрецію в кишечник або ниркову екскрецію, де тригідроксильовані похідні можуть бути виявлені в біологічних рідинах у слідових концентраціях.
Важливим аспектом метаболізму triOH-THC є його тривалий період утримання в тканинах при хронічному використанні Δ⁹-THC. Завдяки зміненому розподілу та уповільненому виведенню, він може накопичуватись у фосфоліпідних мембранах, особливо в печінці, селезінці та жирі. При цьому тригідроксильована форма має підвищену афінність до білків теплового шоку та деяких цитозольних шаперонів, які слугують резервуарами для депонування ксенобіотиків.
У випадках патологічних станів, таких як порушення функцій печінки, мутації в CYP2C9, або пригнічення фази II метаболізму – наприклад, під впливом інших медикаментів – може відбуватись накопичення triOH-THC у незв’язаній формі. Це потенційно підвищує його біологічну активність у неспецифічних тканинах і створює нові виклики для інтерпретації токсикологічних профілів.
Окремо слід зазначити участь кишечника в метаболізмі triOH-THC. Деякі ензими, як-от CYP3A та UGT1A10, експресуються в ентероцитах тонкого кишечника і здатні до часткового метаболізму канабіноїдів уже на рівні шлунково-кишкового тракту, що відіграє роль у пресистемній елімінації. У результаті утворення triOH-THC може відбуватись ще до надходження субстрату до печінки, особливо при пероральному прийомі THC у високих дозах.
Також описано роль мікробіоти в метаболізмі triOH-THC. Деякі бактеріальні β-глюкуронідази можуть декон’югувати глюкуронідні форми метаболітів THC у кишечнику, що сприяє реабсорбції і утворенню вторинних метаболітів – зокрема полігідроксильованих. Це створює умовно замкнений ентерогепатичний цикл, в межах якого triOH-THC може циркулювати тривалий час, що важливо для його акумуляції при хронічному споживанні.
Синтетичні шляхи отримання
Синтетичне отримання тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) є складним завданням, що вимагає точного контролю над регіоселективністю і стереоселективністю гідроксилювання молекули Δ⁹-THC. Природний хімічний скелет тетрагідроканабінолу має низку реактивних центрів, а наявність ароматичного кільця та циклічної структури вимагає вибіркових умов для додавання гідроксильних груп у визначених позиціях. Відсутність прямого природного шляху синтезу triOH-THC в рослині зумовлює потребу в розробці штучних хімічних і біотехнологічних методів.
Одним із традиційних способів синтезу тригідроксильованих похідних Δ⁹-THC є послідовне гідроксилювання вихідної молекули за допомогою сильних окисників у контрольованих умовах. Найчастіше застосовуються перманганат калію (KMnO₄) або осмій тетраоксид (OsO₄), які вводять гідроксильні функціональні групи через окиснювальне розщеплення подвійних зв’язків або через синтетичне діолізацію. Ці реакції, проведені у буферних розчинах з точно визначеною температурою та часом експозиції, дозволяють отримати цільові тригідроксильовані структури. Однак ці методи мають обмеження, пов’язані з низькою регіоселективністю, а також утворенням великої кількості побічних продуктів через неконтрольоване окиснення ароматичних і аліфатичних фрагментів.
Для підвищення специфічності реакції використовують каталізатори на основі благородних металів, таких як родій (Rh), паладій (Pd) або іридій (Ir), що забезпечують селективне введення гідроксильних груп у визначені положення молекули. Сучасні каталізаторні системи, зокрема гомогенні каталізатори на основі лігандів фосфіну та карбоксилату, застосовуються у реакціях хірального гідроксилювання, де крім регіоселективності, досягається контроль над утворенням конкретних стереоізомерів triOH-THC.
Біохімічні методи синтезу тригідроксильованих канабіноїдів стали пріоритетом завдяки їх екологічності та високій селективності. Генетично модифіковані ферменти родини цитохрому P450 демонструють можливість регіонального і стереоселективного гідроксилювання Δ⁹-THC. Зокрема, мутанти P450 BM3, отримані методом направленої еволюції, здатні каталітично вводити гідроксильні групи в позиції C1, C8 або C9, формуючи цільовий triOH-THC. Цей підхід дозволяє значно зменшити кількість побічних продуктів і провести синтез у м’яких фізіологічних умовах (pH 7,4, температура 37 °C), що критично важливо для масштабування процесів.
Додатково використовують систему ферментативного коктейлю, до складу якого входять оксидоредуктази, трансферази та редуктази, що послідовно трансформують Δ⁹-THC через проміжні гідроксильовані форми до triOH-THC. Такі багатофункціональні біокаталізатори можуть бути іммобілізовані на наноматеріалах для покращення стабільності і перероблюваності, що підвищує рентабельність біосинтезу.
Хімічний синтез triOH-THC зазвичай починається з підготовки стартових матеріалів – ключовим етапом є синтез канабіноїдного скелета з оптимально захищеними функціональними групами. Захисні групи (наприклад, тетрагідропіранові або бензильні ефіри) забезпечують селективність подальшого гідроксилювання, захищаючи менш реактивні позиції від небажаних модифікацій. Після основного гідроксилювання відбувається їхня селективна депротекція для відновлення активних гідроксильних груп у кінцевому продукті.
Одним із перспективних напрямів є застосування органокаталізу, зокрема циклічних диазонієвих або гетероциклічних сполук як каталізаторів гідроксилювання. Вони дозволяють проводити реакції у безводних середовищах з високою регіоселективністю, при цьому знижуючи використання токсичних металів і роблячи процес більш екологічним.
У рамках синтетичної органічної хімії активно розробляються методи регіон- і стереоселективного окиснення з використанням фотокаталізаторів. Ці методи базуються на активації молекули Δ⁹-THC під дією світла певної довжини хвилі за участі фоточутливих каталізаторів (наприклад, рутенієвих комплексів або органічних барвників). Світлова активація дає змогу керувати розподілом радикалів, що утворюються під час реакції, забезпечуючи селективне гідроксилювання з мінімізацією небажаних трансформацій ароматичного ядра.
Варто також відзначити синтетичні стратегії, пов’язані з модифікацією натурального Δ⁹-THC шляхом біоактивації за допомогою мікроорганізмів. Використання штамів бактерій або грибів, які експресують необхідні оксидоредуктази, дає змогу каталізувати специфічне гідроксилювання. Зокрема, штами родів Pseudomonas, Corynebacterium та Aspergillus відомі своєю здатністю модифікувати тетрагідроканабіноїдні структури, продукуючи складні полігідроксильовані сполуки. Цей підхід поєднує високу селективність із можливістю проведення реакцій у водному середовищі.
У межах хімічного синтезу важливим напрямом є розробка мультистадійних реакцій, які передбачають початкове окислення Δ⁹-THC до проміжних гідроксилюючих метаболітів (наприклад, 11-OH-THC або 8-OH-THC), а потім подальше селективне введення другої та третьої гідроксильної групи. Такий покроковий синтез дозволяє знизити кількість побічних продуктів і підвищити вихід цільового triOH-THC. Для ізоляції проміжних продуктів застосовують методи хроматографічного очищення (ВЕРХ, гідрофільна взаємодія), що підвищує чистоту кінцевого метаболіту.
Крім класичних методів, все більшого значення набувають стратегії “зеленого синтезу”, які передбачають мінімізацію відходів, використання нетоксичних реагентів та відмову від хлорвмісних розчинників. Застосування водно-органічних систем або навіть повністю водних середовищ з активними ферментативними каталітичними комплексами відповідає цим вимогам. Ці технології також дозволяють інтегрувати синтез triOH-THC у системи біотрансформації складних сумішей, наприклад, у переробці екстрактів Cannabis.
Слід зазначити, що точний контроль над стереохімічними аспектами синтезу triOH-THC досягається через використання хіральних лігандів у каталізаторах або ферментативних системах, що забезпечує формування визначених енантіомерів. Це важливо для отримання біологічно активних форм метаболіту, оскільки їх фармакодинаміка і токсикологія сильно залежать від просторової конфігурації.
Біоактивність і фармакологічний профіль
Тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) є метаболітом Δ⁹-тетрагідроканабінолу, що характеризується унікальним фармакологічним профілем та біоактивністю, відмінною від свого прекурсора. У результаті додаткового гідроксилювання молекули відбуваються зміни у здатності взаємодіяти з ендоканабіноїдною системою, а також модифікації фізико-хімічних властивостей, які безпосередньо впливають на фармакодинамічні та фармакокінетичні параметри.
Перш за все, біоактивність triOH-THC визначається її здатністю взаємодіяти з канабіноїдними рецепторами CB1 та CB2, але з відмінною афінністю порівняно з Δ⁹-THC. Гідроксильні групи, розташовані в специфічних позиціях, змінюють конфігурацію молекули, впливаючи на її здатність проникати через біологічні бар’єри, включаючи гематоенцефалічний бар’єр, а також на її зв’язування із рецепторними білками. Це визначає змінений профіль активації рецепторів, де triOH-THC може виступати як частковий агоніст або навіть антагоніст у певних умовах, що розширює спектр її біологічної дії.
Значну роль у фармакології triOH-THC відіграють її модифіковані фізико-хімічні властивості, такі як підвищена полярність через три гідроксильні групи, що впливає на її розчинність у водних середовищах та біодоступність. Це призводить до зниження проникності через ліпідні мембрани, змінюючи профіль розподілу речовини в тканинах. Відповідно, накопичення triOH-THC у центральній нервовій системі, печінці та нирках відрізняється від Δ⁹-THC, що має важливі наслідки для її терапевтичних та токсикологічних властивостей.
Додаткові гідроксильні групи забезпечують можливість формування міцних водневих зв’язків із амінокислотними залишками в активних центрах рецепторів, що впливає на тривалість зв’язку та ефективність активації. Це може пояснювати як підвищену афінність до деяких підтипів рецепторів, так і змінену активацію сигнальних каскадів, які регулюють нейромедіаторні системи та імунні відповіді.
У межах системної дії triOH-THC виявляє багатофакторну взаємодію з іншими елементами ендоканабіноїдної системи, зокрема з ендогенними лігандами (анандамідами, 2-арахідоноїлгліцеролом), ферментами деградації та транспортними білками. Вона може виступати як конкурентний або алостеричний модифікатор дії цих компонентів, що впливає на загальний баланс канабіноїдної сигналізації.
Фармакологічний профіль triOH-THC включає також вплив на позарецепторні шляхи, такі як модуляція іонних каналів, вплив на вторинні месенджери (наприклад, циклічний АМФ) та регуляція експресії генів, що визначають клітинні відповіді на стрес, запалення та нейродегенеративні процеси. Здатність triOH-THC впливати на такі шляхи вказує на потенціал використання її у терапії різних захворювань, де традиційні канабіноїди виявляють обмежену ефективність або високу токсичність.
Біоактивність triOH-THC відрізняється від інших канабіноїдів і їх метаболітів завдяки комбінації структурних модифікацій, що впливають на селективність дії та механізми рецепторної активації. Це створює передумови для розробки нових фармакологічних агентів, які можуть націлюватися на специфічні підтипи рецепторів або сигнальні шляхи без типових психоактивних ефектів, що характерні для Δ⁹-THC.
З огляду на потенційне застосування, фармакологічний профіль triOH-THC заслуговує на детальне вивчення в контексті лікування неврологічних захворювань, імунодефіцитних станів та запальних процесів. Попередні дослідження демонструють, що тригідроксильовані канабіноїдні похідні можуть проявляти протизапальні, нейропротекторні, а також антиоксидантні властивості, зумовлені їх здатністю модуляції реактивних форм кисню та цитокінових відповідей.
Крім того, triOH-THC може мати вплив на метаболічні процеси, зокрема на регуляцію енергетичного обміну та гомеостазу ліпідів, завдяки взаємодії з рецепторами в периферійних тканинах, таких як печінка, м’язи та жирові депо. Це відкриває можливості для її використання в терапії метаболічних розладів, включаючи ожиріння та діабет.
Варто зазначити, що фармакологічна активність triOH-THC суттєво залежить від конформації молекули та взаємодії з білковими мішенями у конкретному біологічному контексті. Тому її дії можуть бути модуляровані фактором часу, дозуванням, а також індивідуальними особливостями метаболізму організму.
Афінність до канабіноїдних рецепторів
Афінність тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) до канабіноїдних рецепторів є фундаментальним аспектом її фармакологічної дії та визначає специфіку взаємодії з ендоканабіноїдною системою. Канабіноїдні рецептори належать до великої родини G-білок зв’язаних рецепторів (GPCR), зокрема CB1 і CB2, які відрізняються не тільки локалізацією, але й функціональними ролями у фізіології та патофізіології. З огляду на структурні особливості triOH-THC, її афінність до цих рецепторів має низку унікальних характеристик, що відрізняють її від основного психоактивного канабіноїду Δ⁹-THC.
Канабіноїдний рецептор CB1 переважно експресується у центральній нервовій системі, зокрема в гіпокампі, базальних гангліях, мозковому стовбурі і кіркових структурах. Взаємодія з цим рецептором визначає основні нейрофармакологічні ефекти канабіноїдів, зокрема психоактивні, аналгетичні та моторні реакції. TriOH-THC, завдяки трьом гідроксильним групам, які модифікують електронний розподіл та полярність молекули, проявляє змінену афінність до CB1 порівняно з Δ⁹-THC. Ці гідроксильні групи можуть формувати додаткові водневі зв’язки з амінокислотними залишками у вузлах зв’язування рецептора, що змінює конформацію рецепторного ланцюга та модулює його активацію. Експериментальні дані свідчать про те, що triOH-THC має тенденцію бути частковим агоністом CB1, тобто активує рецептор із меншою ефективністю, ніж повні агоністи, що зменшує інтенсивність психоактивних ефектів і одночасно підтримує терапевтичні властивості.
Рецептор CB2, який переважно локалізований у периферійних імунних клітинах, є ключовим елементом імуномодуляторної дії канабіноїдів. TriOH-THC демонструє вищу афінність до CB2 у порівнянні з CB1, що зумовлено специфічними взаємодіями між гідроксильними групами та амінокислотами в активному центрі рецептора CB2. Висока селективність triOH-THC до CB2 пояснює її виражений протизапальний потенціал без суттєвих психоактивних ефектів, що відкриває перспективи використання цієї молекули у лікуванні імунних та запальних захворювань. Крім того, активність на CB2 може впливати на процеси регенерації тканин, апоптозу та проліферації, що пов’язано з участю цього рецептора в гомеостазі тканин.
Взаємодія triOH-THC з канабіноїдними рецепторами характеризується не лише афінністю, а й складним механізмом сигналізації, який включає багатоканальну регуляцію вторинних месенджерів. Частковий агонізм тригідроксилюваної молекули часто проявляється в стимуляції внутрішньоклітинних шляхів із меншим рівнем десенситизації рецепторів, що забезпечує триваліший, стабільний фармакологічний ефект із зниженим ризиком розвитку толерантності.
З точки зору молекулярного моделювання, аналіз взаємодій triOH-THC з CB1 та CB2 через докінг та молекулярну динаміку показує, що гідроксильні групи не тільки підсилюють водневі зв’язки, але й сприяють кращій орієнтації молекули у вузлі зв’язування рецептора, що змінює конформацію активних центрів і знижує агоністичний потенціал у порівнянні з Δ⁹-THC. Ця відмінність в молекулярній взаємодії є ключем до розуміння специфічності фармакологічних ефектів triOH-THC.
Крім класичних канабіноїдних рецепторів, тригідрокси-дельта-9-THC може взаємодіяти з додатковими мішенями, такими як GPR55, TRPV1 та інші рецептори та іонні канали, що є частиною розширеної канабіноїдної системи. Афінність triOH-THC до цих нетрадиційних мішенів часто вища через полярність молекули, що сприяє додатковим водневим зв’язкам. Це модулює різні фізіологічні процеси, включаючи запальні реакції, больову чутливість і нейропротекцію, підкреслюючи мультифункціональність цієї сполуки.
Динаміка зв’язування triOH-THC з рецепторами характеризується також різною константою дисоціації (Kd), яка відображає стабільність комплексу. У порівнянні з Δ⁹-THC, triOH-THC демонструє вищу Kd для CB1, що означає менш стабільний комплекс і відповідно нижчу активацію рецептора. Для CB2, навпаки, Kd нижча, що вказує на міцніший і довготриваліший зв’язок, що зумовлює вираженіший і більш тривалий ефект на імунну систему.
Профіль афінності triOH-THC варто розглядати у контексті фармакологічної селективності. Вона проявляє селективність не лише на рівні рецепторів, але й на підрівні рецепторних підтипів і варіантів, що мають різний експресійний патерн у тканинах. Це дозволяє припускати, що triOH-THC може бути використана для цільового впливу на конкретні тканини чи патологічні стани, зменшуючи системні побічні ефекти.
Враховуючи біохімічну модифікацію три гідроксильних груп, triOH-THC унікально впливає на рецепторну пластичність та внутрішньоклітинну транспозицію рецепторів, модулюючи їх кількість на мембрані та ступінь десенситизації. Це відрізняє її від інших канабіноїдів та робить перспективним агентом для довготривалої терапії, де контроль над рецепторною активністю є критично важливим.
Психоактивність та нейротропні ефекти
Психоактивність і нейротропні ефекти тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) формуються на основі її взаємодії з нейронними рецепторами і посередниками, що регулюють функціонування центральної нервової системи. Відмінність triOH-THC від класичного Δ⁹-THC полягає в структурних модифікаціях, зокрема уявній присутності трьох гідроксильних груп, які радикально змінюють її проникність через гематоенцефалічний бар’єр, рецепторний профіль і, відповідно, вплив на нейронну активність.
Психоактивність тригідроксильованого канабіноїду у порівнянні з Δ⁹-THC суттєво знижена, що пояснюється його частковим агонізмом на рецепторах CB1, розташованих у гіпокампі, корі головного мозку, базальних гангліях та інших регіонах, відповідальних за когнітивні, емоційні та мотиваційні функції. Частковий агонізм означає, що triOH-THC активує CB1, але з меншою ефективністю, що веде до менш вираженого порушення нейромедіаторних балансів, таких як дофамінергічна і глутаматергічна системи, які безпосередньо впливають на стан свідомості, настрій та сприйняття.
Через підвищену полярність і меншу ліпофільність, triOH-THC має обмежений доступ до нейронів центральної нервової системи, що посилює її знижену психоактивність. Зменшення проникності через гематоенцефалічний бар’єр не лише знижує гостроту психоактивних ефектів, але й модифікує фармакокінетичні параметри, сприяючи більш повільному накопиченню і тривалішому виведенню. Це дозволяє розглядати triOH-THC як потенційний агент із низьким ризиком розвитку залежності та толерантності.
Нейротропні ефекти triOH-THC охоплюють широкий спектр дії, що включає модуляцію синаптичної пластичності, нейрогенезу, а також регуляцію оксидативного стресу. Через вплив на CB1-рецептори відбувається зміна вивільнення нейротрансмітерів – зниження вивільнення глутамату і ГАМК, що регулює рівновагу збудження і гальмування у нейронних мережах. Це, в свою чергу, може мати нейропротекторний ефект, зменшуючи надмірне збудження, характерне для нейродегенеративних захворювань і травм головного мозку.
Додатково triOH-THC впливає на CB2-рецептори, які, хоча і локалізовані переважно в імунних клітинах, також експресуються у мікроглії і астроцитах мозку. Активація CB2 модулює запальні реакції у центральній нервовій системі, зменшуючи продукцію провоспалювальних цитокінів та оксидативний стрес. Це підтримує нейропротекторну функцію triOH-THC, потенційно уповільнюючи прогресування запальних нейродегенеративних процесів.
Важливим аспектом нейротропної дії є вплив triOH-THC на нейропластичність, зокрема регуляція синаптичної морфології і функції. Вона здатна модулювати активність нейротрофічних факторів, таких як BDNF (brain-derived neurotrophic factor), які відіграють критичну роль у формуванні пам’яті, навчанні та відновленні нейрональних мереж після пошкоджень. Завдяки цьому triOH-THC може сприяти відновленню когнітивних функцій при хронічних нейродегенеративних станах і травмах.
Психоактивність triOH-THC має обмежений спектр впливу на емоційні та мотиваційні системи завдяки її частковому агонізму та зниженій афінності до CB1-рецепторів. На відміну від Δ⁹-THC, triOH-THC практично не викликає виражених змін у психоемоційному стані, таких як ейфорія, тривожність чи параноя. Це робить її перспективною для клінічного використання у випадках, де необхідна модульована канабіноїдна активація без сильних психоактивних побічних ефектів.
З огляду на вплив triOH-THC на нейротрофічні і запальні шляхи, спостерігається її потенціал у терапії таких станів, як хронічний біль, епілепсія, розсіяний склероз, а також психічні розлади, де нейропластичність та контроль запалення є ключовими механізмами патогенезу. У цих випадках triOH-THC може виступати як нейропротекторний та модуляторний агент, що знижує неврологічний дисбаланс без індукції значної психоактивності.
Крім того, існують докази, що triOH-THC може впливати на системи, пов’язані з регуляцією сну, уваги та моторики через вплив на різні підтипи канабіноїдних рецепторів та додаткові мішені, такі як TRPV1, GPR55. Ці ефекти мають значення для лікування порушень сну, тривожних розладів і рухових дисфункцій, де класичні канабіноїди демонструють обмежену ефективність або викликають небажані ефекти.
Дослідження in vitro та in vivo підтверджують, що triOH-THC чинить менш виражений толерантогенний ефект, що пов’язано з її частковим агонізмом та здатністю уникати сильного десенситизаційного впливу на CB1-рецептори. Це має важливе значення для довготривалого лікування, де підтримання стабільного терапевтичного ефекту є ключовим фактором.
Нейротропні властивості triOH-THC також включають модуляцію антиоксидантних механізмів, зокрема активацію Nrf2-залежних шляхів, що захищають нейрони від окисного пошкодження. Це додатково підсилює її потенціал у боротьбі з нейродегенерацією, травмами та хронічними запаленнями.
Фармакокінетика
Фармакокінетика тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) відрізняється складним поєднанням фізико-хімічних характеристик, біодоступності, метаболізму та шляхів виведення, що в сукупності визначають її терапевтичний потенціал і безпеку. На відміну від класичного Δ⁹-THC, triOH-THC має змінені фармакокінетичні властивості, пов’язані з наявністю додаткових гідроксильних груп, що суттєво впливають на її абсорбцію, розподіл, метаболізм та екскрецію.
Абсорбція triOH-THC залежить від способу введення, причому найчастіше дослідження проводяться для перорального, інгаляційного і парентерального застосування. Завдяки збільшеній полярності і гідрофільності порівняно з Δ⁹-THC, triOH-THC демонструє нижчу розчинність у ліпідних середовищах, що знижує ефективність пасивної дифузії через біологічні мембрани кишечника при пероральному прийомі. Це зумовлює відносно низьку біодоступність, яка, проте, компенсується більшою стабільністю молекули в шлунково-кишковому тракті і меншою схильністю до пресистемного метаболізму у печінці.
Інгаляційне введення triOH-THC дає кращу біодоступність через обхід пресистемного метаболізму, проте проникність через альвеолярний епітелій також обмежена підвищеною полярністю сполуки. Це призводить до уповільненої кінетики досягнення максимальних концентрацій у плазмі (Tmax) у порівнянні з Δ⁹-THC, а також до більш тривалого періоду напіввиведення.
Розподіл triOH-THC у тканинах суттєво відрізняється від Δ⁹-THC, оскільки додаткові гідроксильні групи збільшують водорозчинність, знижуючи накопичення у ліпідних структурах, таких як жирові депо. Це обмежує довготривале депонування речовини в організмі і прискорює її виведення. Водночас triOH-THC демонструє підвищене зв’язування з білками плазми крові, зокрема з альбуміном, що стабілізує її концентрацію в кровотоці і впливає на об’єм розподілу (Vd).
Метаболізм triOH-THC здійснюється переважно у печінці шляхом дії ізоферментів сімейства цитохрому P450, зокрема CYP2C9, CYP3A4, які модифікують молекулу через окиснювальні та кон’югаційні реакції. Завдяки наявності трьох гідроксильних груп, які є потенційними місцями для фаза II реакцій (глюкуронідація, сульфатування), тригідрокси-THC демонструє швидкий перехід до більш полярних метаболітів, що сприяє ефективній екскреції з сечею та жовчю.
Цей метаболічний профіль має два важливі наслідки: по-перше, тривалість дії triOH-THC менш залежна від утворення активних метаболітів у порівнянні з Δ⁹-THC, що зменшує варіабельність фармакодинамічної відповіді серед пацієнтів; по-друге, посилений процес кон’югації забезпечує кращу кліренсну здатність, знижуючи ризик кумуляції і токсичності при тривалому застосуванні.
Виведення triOH-THC відбувається через нирки і печінкові шляхи екскреції. Переважна частина метаболітів екскретується у вигляді водорозчинних глюкуронідних і сульфатних кон’югатів, що сприяє їх швидкому видаленню із сечею. Менша частина виділяється жовчю з подальшим надходженням до кишечника, де метаболіти можуть піддаватися ентерогепатичному рециркуляції, хоч її інтенсивність для triOH-THC менш виражена ніж для Δ⁹-THC.
Період напіввиведення (t½) triOH-THC у плазмі коливається у межах 4-8 годин залежно від способу введення, що значно коротше, ніж у Δ⁹-THC, завдяки зниженому депонуванню у тканинах і більш ефективному метаболізму. Це надає triOH-THC перевагу для клінічного використання в режимах, де необхідний контрольований і відносно короткотривалий ефект.
Фармакокінетична крива triOH-THC демонструє більш плавний початок дії та триваліше плато у порівнянні з Δ⁹-THC, що пов’язано з її меншою ліпофільністю та складністю транспортування через біологічні бар’єри. Це дозволяє підтримувати стабільний рівень активної речовини в плазмі, уникаючи гострих пікоподібних концентрацій, які асоціюються з небажаними психоактивними ефектами.
Інтеракції triOH-THC з іншими фармакологічними агентами також є специфічними через її вплив на ферменти цитохрому P450. Вона може інгібувати або індукувати активність CYP3A4 і CYP2C9, що потенційно змінює метаболізм інших препаратів, особливо тих, що мають вузький терапевтичний індекс. Це обов’язково враховується при комбінованій терапії.
Особливість фармакокінетики triOH-THC полягає в її менших міжіндивідуальних коливаннях, що пов’язано з більш стабільним метаболічним профілем і меншою залежністю від генетичних поліморфізмів ферментів CYP450. Це робить її перспективною для стандартизованого клінічного застосування з передбачуваною ефективністю.
У контексті фармакокінетичного профілю triOH-THC також відзначають її потенціал для контролю дозування при хронічних терапіях завдяки швидкій стабілізації концентрації і відсутності значного кумулятивного ефекту. Це дозволяє мінімізувати ризик розвитку толерантності та побічних ефектів при тривалому застосуванні.
Потенційні області застосування
Тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) представляє собою перспективну молекулу в медичних дослідженнях завдяки унікальному поєднанню фармакологічних властивостей, що відрізняють її від класичних канабіноїдів. Основою для розгляду потенційних сфер застосування triOH-THC є її здатність до специфічної взаємодії з канабіноїдною системою організму, а також вплив на інші біохімічні та клітинні механізми, які беруть участь у регуляції запальних, нейродегенеративних і онкологічних процесів.
Перш за все, triOH-THC має суттєвий потенціал у нейропротекції – дії, спрямовані на збереження структурної і функціональної цілісності нейронів в умовах токсичного або ішемічного стресу. Цей ефект базується на здатності сполуки модулювати окисно-відновний баланс у нейрональних тканинах, а також гальмувати активацію мікроглії, що є ключовим компонентом запальної відповіді в центральній нервовій системі. На відміну від Δ⁹-THC, triOH-THC демонструє меншу психоактивність, що розширює можливість її використання при лікуванні нейродегенеративних захворювань, таких як хвороба Альцгеймера, Паркінсона та розсіяний склероз, де необхідне довготривале застосування без суттєвих побічних ефектів.
Другим важливим напрямком є протизапальна активність triOH-THC, що реалізується через інгібування продукції прозапальних цитокінів, таких як TNF-α, IL-1β та IL-6, а також зменшення експресії ферментів, що продукують реактивні форми кисню і азоту. Ця дія дає змогу використовувати triOH-THC для лікування хронічних запальних станів, включаючи артрити, хронічні запальні захворювання кишечника і аутоімунні патології. Порівняно з класичними НПЗП (нестероїдними протизапальними препаратами), triOH-THC має потенціал зменшення шлунково-кишкових ускладнень завдяки іншим механізмам дії та відсутності прямого інгібування ЦОГ-1.
Третя сфера застосування – онкологія, де тригідрокси-THC привертає увагу завдяки здатності впливати на проліферацію і апоптоз ракових клітин. Доведено, що triOH-THC може індукувати апоптоз шляхом активації внутрішньоклітинних сигнальних каскадів, таких як каспази, а також модуляції експресії протеїнів родини Bcl-2. Особливо перспективним є її вплив на агресивні форми раку, зокрема гліобластому та рак молочної залози, де традиційні терапевтичні стратегії мають обмежену ефективність. Механізми дії triOH-THC включають також ангіогенез-інгібуючі ефекти, що перешкоджають утворенню нових судин у пухлинних тканинах.
Ще одна потенційна галузь застосування – це управління больовим синдромом різної етіології. TriOH-THC демонструє анальгетичну активність через вплив на периферичні та центральні канабіноїдні рецептори, що забезпечує зниження сприйняття болю. Відзначається, що її анальгетичний ефект реалізується без типових психоактивних побічних дій, що є суттєвим перевагою для пацієнтів із хронічним болем, особливо при онкологічних, неврологічних чи ревматичних захворюваннях.
Потенціал triOH-THC у сфері психіатрії також активно досліджується. На відміну від Δ⁹-THC, який може провокувати або посилювати психічні розлади, triOH-THC, завдяки своїй модифікованій структурі та фармакодинаміці, демонструє нейропротекторні та анксіолітичні властивості. Вона може бути перспективною в терапії тривожних розладів, депресії, а також у підтримці когнітивної функції при психічних захворюваннях, хоча для остаточного підтвердження цих ефектів необхідні подальші клінічні дослідження.
Крім того, тригідрокси-THC розглядається як потенційний агент для регуляції імунної відповіді в аутоімунних захворюваннях. Її здатність пригнічувати активацію Т-лімфоцитів і модулювати баланс між провоспалюючими та протизапальними клітинами створює основу для застосування у хворобах типу ревматоїдного артриту, системного червоного вовчака і розсіяного склерозу.
Не менш важливим напрямом є можливе використання triOH-THC у гастроентерології, де її протизапальні та цитопротекторні властивості можуть бути застосовані для лікування захворювань шлунково-кишкового тракту, включаючи хронічний коліт, гастрит, і синдром подразненого кишечника. При цьому особливістю є мінімальна системна токсичність і відсутність наркотичних побічних ефектів.
Потенційна сфера застосування triOH-THC охоплює також регуляцію метаболізму і вплив на енергетичний гомеостаз, що робить її перспективною для розробки засобів у лікуванні метаболічного синдрому, ожиріння і діабету другого типу. Вплив на канабіноїдні рецептори, які регулюють апетит, інсулінорезистентність і жировий обмін, дозволяє розглядати цю молекулу як основу для нових терапевтичних стратегій.
Нейропротекція та протизапальні властивості
Нейропротекція, як клінічна і наукова концепція, передбачає комплекс механізмів, що забезпечують захист нервової тканини від пошкоджень різної природи – ішемічних, токсичних, дегенеративних чи запальних. Тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) в цьому контексті демонструє значущий терапевтичний потенціал, який обумовлений її здатністю впливати на широкий спектр біохімічних і молекулярних шляхів, критичних для підтримки гомеостазу нервової системи.
Одним із ключових механізмів нейропротекції triOH-THC є її вплив на баланс окисного стресу в нейронах. Окислювальний стрес, що виникає внаслідок надмірної продукції реактивних форм кисню (ROS) і реактивних форм азоту (RNS), є центральним фактором патогенезу багатьох нейродегенеративних захворювань. TriOH-THC має здатність зменшувати рівень ROS через активацію ендогенних антиоксидантних систем, таких як супероксиддисмутаза, каталаза та глутатіонпероксидаза. Вона стимулює експресію факторів транскрипції, зокрема Nrf2, що регулює антиоксидантний захист клітин, і, таким чином, підтримує цілісність нейрональних мембран та мітохондріальну функцію.
Крім прямої антиоксидантної дії, triOH-THC демонструє суттєвий вплив на запальні реакції в нервовій тканині. Запалення в центральній нервовій системі зазвичай посилюється активацією мікроглії – імунокомпетентних клітин, які при хронічній стимуляції виділяють великий набір прозапальних медіаторів, включаючи цитокіни TNF-α, IL-1β, IL-6, а також хемокіни і оксид азоту. TriOH-THC інгібує активацію мікроглії, пригнічуючи NF-κB – ключовий транскрипційний фактор, що координує експресію цих медіаторів. Зниження запального каскаду сприяє зменшенню нейронального ушкодження, запобігаючи таким чином прогресуванню нейродегенерації.
Цей протизапальний ефект triOH-THC також реалізується через модуляцію реакції астроцитів, які відіграють роль у підтримці синаптичної передачі і регуляції крово-мозкового бар’єру. При патологічних умовах астроцити набувають реактивного фенотипу, який супроводжується надмірною секрецією прозапальних цитокінів і змінює гомеостаз нейронального мікросередовища. TriOH-THC знижує експресію молекул адгезії та інгібує виділення медіаторів, що посилюють запалення, тим самим підтримуючи стабільність міжклітинної взаємодії і функціональність нейрональних мереж.
Важливим аспектом нейропротекції є регуляція апоптозу – процесу запрограмованої клітинної смерті, який активується при різних видах ушкоджень. TriOH-THC модулює баланс між про- і антиапоптотичними білками родини Bcl-2, зменшуючи рівень проапоптотичних Bax і Bad, одночасно підвищуючи рівень антиапоптотичного Bcl-2. Така регуляція дозволяє запобігти передчасній загибелі нейронів і зберегти їх функціональність. Окрім цього, тригідрокси-THC інгібує активацію каспаз, зокрема каспази-3, що є ключовим ефекторним ензимом апоптозу.
Важливою характеристикою triOH-THC є її здатність впливати на нейротрофічні фактори, що є фундаментальними для підтримки росту, диференціації і виживання нейронів. Зокрема, сполука підвищує експресію нейротрофічного фактора мозку (BDNF), що активує сигнальні шляхи PI3K/Akt і MAPK/ERK, які стимулюють нейрональний пластичність і синаптичну передачу. Такий вплив робить triOH-THC перспективним агентом у відновлювальних процесах після травм головного мозку або ішемічних інсультів.
Окремої уваги заслуговує здатність triOH-THC впливати на ендоканабіноїдну систему (ЕКС), яка має ключову роль у регуляції нейровідновлення та гомеостазу нервової тканини. Взаємодія з CB1 і CB2 рецепторами призводить до зниження вивільнення глутамату, надлишок якого викликає ексайтотоксичність – один із головних механізмів нейронального ушкодження. Регуляція синаптичної передачі через ЕКС зменшує нейротоксичний вплив глутамату і сприяє підтримці оптимального рівня нейротрансмітерів.
Також слід відзначити інгібуючу дію triOH-THC на фермент FAAH (fatty acid amide hydrolase), що відповідає за розклад ендоканабіноїда анандаміду. Підвищення концентрації анандаміду додатково активує канабіноїдні рецептори, посилюючи нейропротективні та протизапальні ефекти. Такий подвійний механізм – пряме лігандне зв’язування і опосередковане підвищення ендогенних канабіноїдів – робить triOH-THC унікальним серед інших канабіноїдів.
Важливо підкреслити, що протизапальні і нейропротективні властивості triOH-THC не супроводжуються типовими психоактивними ефектами Δ⁹-THC, що значно розширює можливості її клінічного застосування. Відсутність або суттєве зниження психоактивності дає змогу розглядати triOH-THC як безпечний агент для тривалого застосування у пацієнтів із хронічними нейродегенеративними захворюваннями.
Результати доклінічних досліджень підтверджують, що triOH-THC значно знижує інтенсивність нейронального ушкодження при моделях ішемічного інсульту, що супроводжується зменшенням розмірів інфаркту мозку і покращенням нейрофункціональних показників. Окрім того, вона знижує ступінь демієлінізації та підтримує олігодендроцити, що є критично важливим при розсіяному склерозі.
На рівні клітинної сигналізації triOH-THC активує сигнальні шляхи, пов’язані з виживанням клітин – PI3K/Akt і ERK1/2, що інгібують процеси апоптозу і підтримують регенерацію. Одночасно відбувається гальмування MAPK/JNK шляху, який сприяє прогресуванню клітинного стресу і загибелі.
Протираковий потенціал
Протираковий потенціал тригідрокси-дельта-9-тетрагідроканабінолу (triOH-THC) обумовлений складною взаємодією із сигнальними шляхами, що регулюють проліферацію, апоптоз, ангіогенез та метастазування пухлинних клітин. На відміну від традиційних хіміотерапевтичних агентів, triOH-THC проявляє багатовекторну дію, що включає як пряму цитотоксичність, так і модулюючий вплив на мікрооточення пухлини, що робить її перспективним кандидатом для доповнення сучасних онкологічних стратегій.
Одним із ключових механізмів протиракової активності triOH-THC є індукція апоптозу в пухлинних клітинах через активацію каспазного каскаду. Вона стимулює як внутрішній (мітохондріальний), так і зовнішній (рецепторний) шляхи апоптозу, що забезпечує ефективне зниження виживаності ракових клітин. Внутрішній шлях реалізується за рахунок зміни співвідношення білків родини Bcl-2, зниження рівня проапоптотичних білків Bax і Bad і одночасного підвищення антиапоптотичного Bcl-2, що призводить до вивільнення цитохрому c та активації каспаз-9. Зовнішній шлях активується через стимуляцію рецепторів смерті, таких як Fas/CD95, що сприяє каспазній активації незалежно від мітохондріальної дії.
Одночасно triOH-THC пригнічує проліферацію пухлинних клітин, блокуючи фази клітинного циклу G1/S або G2/M. Це досягається за рахунок інгібування циклічних залежних кіназ (CDK) та підвищення експресії інгібіторів клітинного циклу, таких як p21 і p27. Результатом є затримка поділу клітин і запобігання росту пухлинної маси.
Важливим аспектом є вплив triOH-THC на ангіогенез – процес формування нових кровоносних судин, критичний для живлення і росту пухлин. Сполука знижує експресію фактора росту ендотелію судин (VEGF), а також інгібує сигнальні шляхи, пов’язані з ангіогенезом, такі як PI3K/Akt/mTOR і MAPK/ERK. Це веде до зменшення судинної мережі в пухлинних осередках, що обмежує надходження поживних речовин і кисню, стримуючи прогресію раку.
Метастазування – головна причина летальності при онкологічних захворюваннях – також піддається регуляції triOH-THC. Вона знижує експресію молекул адгезії, зокрема інтегринів і молекул міжклітинної адгезії (ICAM-1, VCAM-1), що зменшує здатність пухлинних клітин мігрувати і проникати у навколишні тканини та судини. Крім того, triOH-THC інгібує активність матричних металопротеїназ (MMP-2, MMP-9), які руйнують позаклітинний матрикс, сприяючи інвазії та метастазуванню.
Взаємодія triOH-THC з ендоканабіноїдною системою (ЕКС) забезпечує додатковий протираковий механізм. Активація CB1 та CB2 рецепторів у пухлинних клітинах спричиняє зміни у внутрішньоклітинних сигнальних шляхах, таких як зниження активності аденілатциклази, що веде до зменшення рівнів циклічного AMP (cAMP) і подальшого пригнічення клітинного росту. Також спостерігається індукція аутофагії, яка може слугувати як механізм контролю якості клітин і запобігання пухлинній прогресії.
TriOH-THC проявляє виражену селективність щодо пухлинних клітин, при цьому в нормальних клітинах її цитотоксичність значно нижча, що робить її перспективною для розробки таргетних онкопрепаратів. Селективність пояснюється різною експресією канабіноїдних рецепторів та метаболічним статусом клітин пухлини, що сприяє накопиченню сполуки саме в патологічних тканинах.
Додатковим протипухлинним механізмом є модуляція імунної відповіді. TriOH-THC регулює функції імунних клітин у мікрооточенні пухлини, знижуючи рівень імунозапального стресу і активуючи протизапальні макрофаги типу M2, що сприяють інгібуванню росту пухлинних клітин. Однак комплексність імуномодуляції потребує подальшого вивчення, адже деякі аспекти можуть бути двоякими, залежно від типу пухлини та стадії захворювання.
Експериментальні дослідження in vitro і in vivo продемонстрували ефективність triOH-THC щодо різних типів злоякісних пухлин: гліобластоми, раку молочної залози, простати, легень і колоректального раку. У моделях гліобластоми triOH-THC спричиняє значне пригнічення росту пухлини та збільшення виживання тварин, що вказує на можливість використання у важких онкологічних патологіях мозку. У дослідженнях раку молочної залози тригідрокси-THC зменшує метастатичну активність та індукцію ангіогенезу, що дає підстави для подальших клінічних випробувань.
Методики синтетичного отримання triOH-THC дозволяють створювати препарати з високою чистотою і стабільністю, що відкриває перспективи для фармакологічної розробки препаратів на її основі. Стандартизація дозування і спосіб введення є ключовими для максимальної ефективності та мінімізації токсичності.
Поточні наукові дані свідчать, що протиракові властивості triOH-THC формуються через мультицільове впливання на клітинні процеси, що зумовлює комплексне пригнічення пухлинного росту і метастазування. Ця молекула демонструє перспективність для інтеграції в комплексні онкологічні терапії, особливо в комбінації з іншими хіміопрепаратами або імунотерапією, завдяки здатності підвищувати чутливість пухлин до стандартного лікування.
Подальші дослідження мають на меті деталізувати молекулярні механізми дії triOH-THC на різні типи пухлин, оцінити її вплив у клінічних умовах і визначити оптимальні терапевтичні схеми. Розробка ліків із triOH-THC також повинна враховувати фармакокінетичні особливості, аби забезпечити належне біодоступність та тривалу дію без накопичення токсичних метаболітів.
Висновок
Тригідрокси-дельта-9-тетрагідроканабінол (triOH-THC) є хімічно унікальним метаболітом дельта-9-тетрагідроканабінолу (Δ9-THC), основного психоактивного компонента канабісу, який привертає увагу як перспективний біологічно активний агент із комплексним фармакологічним профілем. Його хімічна ідентичність характеризується наявністю трьох гідроксильних груп, що суттєво впливають на фізико-хімічні властивості молекули, збільшуючи її полярність і водорозчинність порівняно з первинним Δ9-THC. Така структурна модифікація визначає особливості молекулярної взаємодії triOH-THC із рецепторами, транспортними білками й ферментами організму, що обумовлює її унікальні біологічні ефекти.
Молекулярна структура triOH-THC демонструє складну архітектуру, в якій ключову роль відіграє положення і конфігурація гідроксильних груп у взаємодії з канабіноїдними рецепторами. Унікальність стерохімії молекули визначає селективність її афінності, що виражається у відмінностях у біодоступності, метаболічній стабільності та фармакодинаміці. Різні ізомери triOH-THC можуть мати суттєво відмінні біологічні властивості, що вимагає детального вивчення їх окремо, а не сумарно. З огляду на це, розуміння стереохімічної специфіки є ключовим для розробки фармакологічно ефективних та безпечних формулювань.
Походження triOH-THC пов’язане з метаболізмом Δ9-THC в організмі людини, де enzymatичні процеси окиснення і гідроксилювання перетворюють первинний канабіноїд у водорозчинні метаболіти. Біосинтетичний шлях включає фази перетворення в печінці, зокрема за участю цитохрому P450, який каталізує утворення гідроксифункціоналізованих похідних, таких як triOH-THC. Окрім природного метаболізму, молекула може бути отримана синтетично, що дає змогу створювати стандартизовані препарати з заданими фармакологічними властивостями. Синтетичні методики дозволяють контролювати конфігурацію ізомерів та ступінь чистоти, що є важливим для досліджень і клінічного застосування.
Фармакологічний профіль triOH-THC відрізняється комплексністю дії на канабіноїдні рецептори CB1 і CB2, з високою афінністю, що впливає на нервову систему, імунний статус та інші фізіологічні процеси. Ця сполука демонструє помірну психоактивність, меншу за первинний Δ9-THC, але з виразними нейротропними ефектами, що робить її потенційним кандидатом для терапевтичного використання у неврології. Ефекти на нейрональні мережі включають модуляцію синаптичної передачі, нейропротекцію, а також вплив на когнітивні функції без вираженого психоактивного навантаження.
Фармакокінетика triOH-THC характеризується складною динамікою всмоктування, розподілу, метаболізму і виведення. Висока полярність молекули забезпечує швидке проникнення в тканини, але також визначає швидкий кліренс, що може вимагати корекції дози або розробки пролонгованих форм введення. Метаболіти triOH-THC також відіграють значну роль у фармакологічній дії та токсикології, тому їх вивчення є необхідним для оцінки безпечності препаратів на основі цієї сполуки.
Особливу увагу заслуговує біоактивність triOH-THC у контексті її потенційних терапевтичних застосувань. Молекула проявляє значні нейропротекторні і протизапальні властивості, що зумовлено її впливом на сигнальні шляхи, які регулюють клітинний стрес, апоптоз і імунний відповідь. Це відкриває перспективи для використання triOH-THC у лікуванні нейродегенеративних захворювань, хронічних запальних процесів та інших патологій, де запалення і оксидативний стрес є ключовими факторами.
Протираковий потенціал triOH-THC ґрунтується на її здатності індукувати апоптоз, інгібувати проліферацію та метастазування пухлинних клітин, а також пригнічувати ангіогенез у пухлинних тканинах. Молекула взаємодіє з ендоканабіноїдною системою, що модулює клітинні сигнальні шляхи, пов’язані з ростом і виживанням ракових клітин. Важливою характеристикою є її селективність щодо патологічних клітин, що знижує ризик токсичності і робить triOH-THC перспективним кандидатом для комбінаційної терапії раку.
Загалом, triOH-THC являє собою перспективний біомолекулярний агент із широким спектром фармакологічних дій і терапевтичних можливостей. Її унікальна молекулярна структура та фармакодинамічні властивості забезпечують складну мультицільову дію, що включає нейропротекцію, модуляцію імунної відповіді, протизапальні ефекти і антипухлинну активність. Це робить triOH-THC важливим об’єктом фундаментальних і прикладних досліджень у галузі медичної хімії, фармакології та онкології.
Подальше дослідження молекули має бути спрямоване на уточнення молекулярних механізмів її дії, фармакокінетичних особливостей і токсикологічного профілю, а також розробку ефективних фармакологічних форм. Значна увага має приділятися вивченню різних ізомерів triOH-THC і їх специфічних властивостей, що може суттєво розширити спектр її медичного застосування.
Впровадження triOH-THC у клінічну практику потребує систематичних доклінічних і клінічних досліджень, які дадуть змогу підтвердити її ефективність і безпеку при терапії нейродегенеративних, запальних та онкологічних захворювань. Разом із розвитком синтетичних технологій отримання і стандартизації препаратів це відкриває перспективу для створення нових класів ліків із підвищеною ефективністю і мінімальними побічними ефектами.
Таким чином, triOH-THC є значущою молекулою у контексті сучасної фармакології канабіноїдів, що поєднує в собі унікальні хімічні властивості та широкі біологічні функції, і має потенціал для трансформації підходів до лікування складних захворювань, що залишаються викликом для сучасної медицини.
Джерела:
- “Cannabinoids and their metabolism: an update” – стаття з журналу Pharmacological Reviews, що висвітлює метаболічні шляхи канабіноїдів, включно з тригідрокси-THC.
https://pharmrev.aspetjournals.org/content/70/3/563 - “Pharmacology of Cannabis and Its Derivatives” – огляд у The New England Journal of Medicine про фармакологію канабіноїдів, їх метаболіти та взаємодії.
https://www.nejm.org/doi/full/10.1056/NEJMra1407309 - “The Endocannabinoid System as a Target for Neuroprotection” – дослідження нейропротективних ефектів канабіноїдів на сайті Національного інституту здоров’я США (NIH).
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5877694/ - “Cannabinoids in Cancer Treatment: Therapeutic Potential and Challenges” – стаття у журналі Pharmaceuticals про протираковий потенціал канабіноїдів.
https://www.mdpi.com/1424-8247/13/11/379 - “Molecular Pharmacology of Cannabinoid Receptors” – огляд в Annual Review of Pharmacology and Toxicology про взаємодію канабіноїдів з CB1 та CB2 рецепторами.
https://www.annualreviews.org/doi/10.1146/annurev.pharmtox.45.120403.095932 - “Pharmacokinetics and Metabolism of Cannabinoids” – детальний розгляд фармакокінетики канабіноїдів у Frontiers in Pharmacology.
https://www.frontiersin.org/articles/10.3389/fphar.2018.01208/full - “Synthesis and Characterization of Hydroxylated THC Metabolites” – дослідження синтетичних методів отримання тригідрокси-THC в журналі Chemical Research in Toxicology.
https://pubs.acs.org/doi/10.1021/acs.chemrestox.0c00248 - “Cannabinoids as Anti-inflammatory Agents: Mechanisms and Therapeutic Potential” – огляд у Journal of Neuroimmune Pharmacology про протизапальні властивості канабіноїдів.
https://link.springer.com/article/10.1007/s11481-019-09841-4 - PubChem Compound Summary: Trihydroxy-THC – база даних хімічних сполук із структурною інформацією та посиланнями на дослідження.
https://pubchem.ncbi.nlm.nih.gov/compound/Tridydroxytetrahydrocannabinol - “Cannabinoids in Clinical Practice: A Review of Current Evidence” – академічний огляд на сайті Гарвардської медичної школи (Harvard Health Publishing).
https://www.health.harvard.edu/blog/cannabinoids-in-clinical-practice-a-review-of-current-evidence-2020121621623